更加适合中国人群的HRD检测方法!
在女性肿瘤中,卵巢癌被称为“妇癌之王”,致死率高居妇科恶性肿瘤之首。而卵巢癌一直缺乏有效的筛查策略,被诊断时大多已是晚期。全球每年诊断出近 30 万例新的卵巢癌病例,其中近 20 万例因其死亡。但是过去十年中,5 年生存期几乎没有改善。近期的卵巢癌研究进展多集中在 PARP【聚腺苷二磷酸核糖聚合酶 poly (ADP-ribose) polymerase, PARP】抑制剂相关领域。PARP 抑制剂单药在 BRCA 突变人群中、PARP抑制剂联合抗血管生成药物在同源重组缺陷(HRD)人群中能显著延长新诊断晚期卵巢癌患者总生存,给临床医生和患者都带来了很大的鼓舞[1-3]。
同源重组修复(HRR)是一种 DNA 修复方法,是利用同源重组交换将相同或非常相似 DNA 片段取代原位点受损序列的过程。已知参与同源重组过程的重要基因有十余种,研究发现约三分之一的卵巢癌患者中同源重组基因发生了胚系突变或体细胞突变。而基因组分析显示,高级浆液性卵巢癌(HGSOC)存在同源重组缺陷的比例可以达到约 50%。PARP 抑制剂能大大提高卵巢癌患者的无进展生存期与总生存期,改变原来卵巢癌患者 5 年生存率低迷的局面,使卵巢癌治疗进入了靶向治疗新时代。PARP 抑制剂已被多个国家批准用于晚期卵巢癌,但其使用与否依赖对 HRD 状态的评估。目前仅 2 款基于西方人群设计的 HRD 检测产品通过临床验证且经美国食品药品管理局(FDA)批准:FoundationFocus CDx BRCA LOH Assay 和 Myriad Genetics myChoice® HRD。中国境内尚无 HRD 伴随诊断产品上市[4-6]。
2023 年 2 月,河南省肿瘤医院开展的一项针对中国卵巢癌人群HRD检测和研究的成果《Improved detection of homologous recombination deficiency in Chinese patients with ovarian cancer: a novel non-exonic single-nucleotide polymorphism (SNP)-based next-generation sequencing (NGS) panel》发表在杂志 Molecular Oncology (IF=6.6)。这项临床研究结果表明,文中使用的靶向捕获 Panel 与任何报道的基于 SNP 的 HRD panel 相比,具有更少的 SNP 位点,且更适合中国患者。与 WGS 及 Chip 相比,其检测 HRD 的结果具有相当的一致性,略优于 WES panel。值得注意的是,该研究中使用的 HiSNP Ultra Panel,正是纳昂达科技于 2021 年推出的 HRD 分析 Panel,靶向全基因组范围内 50 Kb 均匀分布的近 5 万个 SNP 位点。
研究方法
标准品:Genewell (CA0792-CA0811,简称GW) 和Cobioer (CGD54143354等,简称KB)。
真实样本:27 例卵巢癌患者肿瘤样本于 2014 年 1 月 1 日至 2022 年 1 月 30 日在河南省癌症医院被诊断为卵巢癌症后采集。
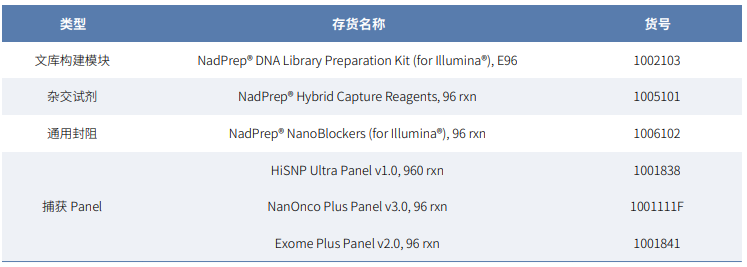
NGS检测方式:本次研究使用 HiSNP-Ultra panel 和Exome Plus panel v2 对标准品进行捕获测序。真实样本则采用 HiSNP-Ultra panel 和 NanOnco Plus Panel v3.0 的混合panel 进行捕获测序,同时也使用 Affymetrix OncoScan Chip和 WGS 对样本进行检测(表1.)。
表1. 文库构建捕获试剂
拷贝数变异和 HRD 分析:本次研究使用 ASCAT 对 Chip芯片的数据进行拷贝数变异和 HRD 分析,而 NGS 捕获测序数据则使用 sequenza 和 facets 以及 scarHRD 软件进行分析。WGS 全基因组测序则由 TitanCNA 软件进行分析,具体软件详情见表2。
表2. 分析软件

HiSNP Ultra Panel 是一款基于 SNP 位点且覆盖全基因的HRD 检测 panel。首先,该 panel 涵盖 52592 个 SNP,这使得它能够检测基因组的不稳定性。第二,所有 SNP 都位于非外显子区域,因此该 panel 可以与任何外显子 panel 配合使用。第三,所选择的 SNP 在中国人中具有较高的次要等位基因频率(MAF),这使其成为中国患者 HRD 检测的更好选择。首先,利用 27 例真实临床样本同时使用 HiSNP Ultra Panel 跟 OncoScan 芯片进行拷贝数变异分析,进而分析全基因组的不稳定性。于此同时,作者还将 HiSNP Ultra Panel 跟泛癌的大 panel NanONco V3 进行混合并行检测患者样本中的驱动和有临床意义的其他突变(图1.)。针对 HiSNP Ultra Panel 跟 OncoScan 芯片检测 HRD 不一致的样本则进一步使用 WGS 测序,用来判断两者的差异和偏好性。
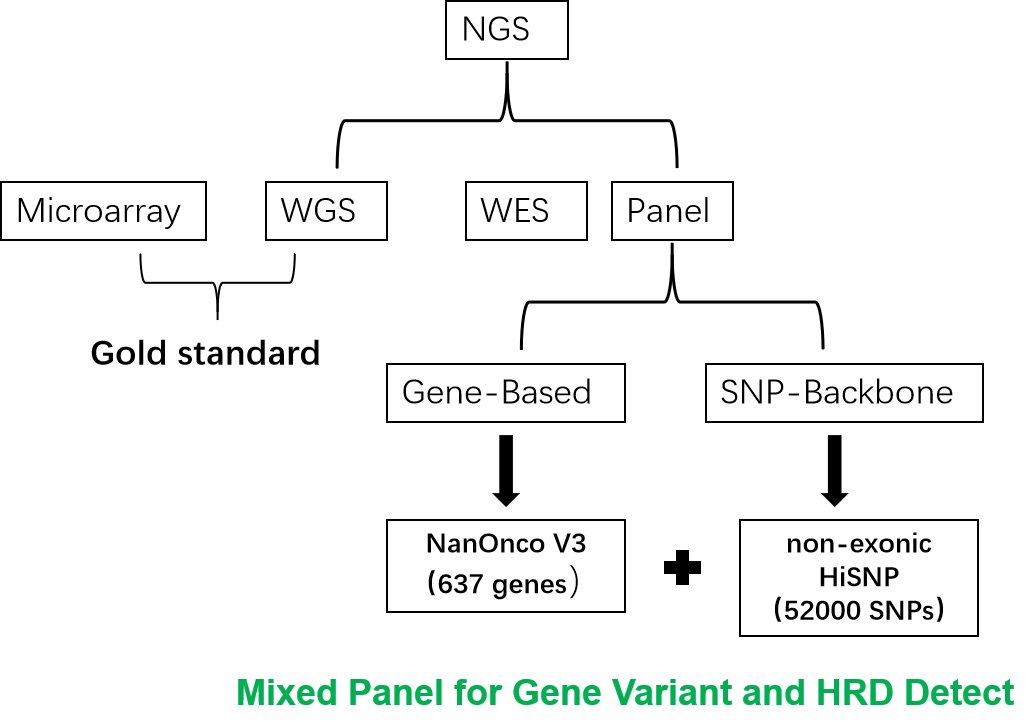

图1.研究中使用的检测方法
文章首先阐述了 HiSNP Ultra Panel 和其他捕获方式的异同(图2.)当应用于检测大规模 CNV(Mb 水平)及计算 LOH、TAI、LST 和 HRD 评分时,SNP 位点的总数可适当减少。所以与 Affymetrix OncoScan™ 比较时,HiSNP Ultra Panel 中的 SNP 位点尽管更少(52592 vs. 217611),但全基因组的分辨率依然维持在 50 kb。
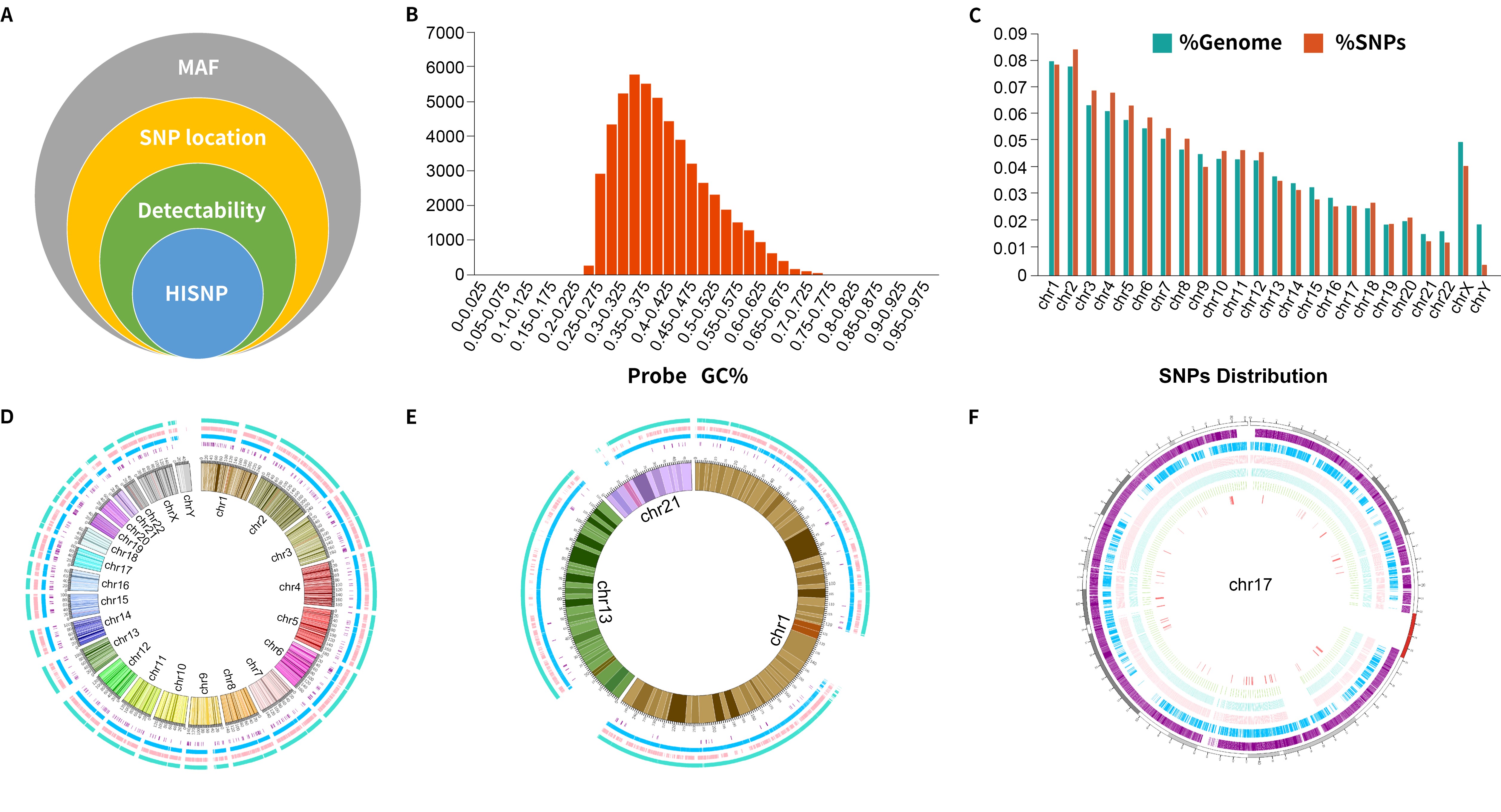
图2. A HiSNP Ultra Panel 设计中考虑的主要因素,设计中筛选了全球5大人群高 MAF 的 SNP 位点,尤其针对中国人群进行了更高的 MAF 的过滤(0.2-0.5)。其次SNP位点的分布必须是均匀分析(50kb 间隔)且SNP 位点必须是避开重复区域,防止后续捕获效果较差。图2.B HiSNP Ultra Panel 中探针的 GC%。图2.C HiSNP Ultra Panel 中每个染色体内的 SNP 分布。图2.D-F HiSNP Ultra Panel、Affymetrix OncoScan™ 、Exome Plus panel v2 和 NanOnco Plus Panel v3.0 中所有染色体内以及 chr1、chr13、chr21 和 chr17 中的SNP分布。
文章接着对 HiSNP Ultra panel 在标准品上 HRD 检测和性能验证。结果表明,HiSNP Ultra panel 和 WGS 对 HRD 的评分计算与标准品的参考值一致(图3.B,表3)。对于HiSNP Ultra Panel,使用 sequenza 分析 ASCN 值更符合参考值。然而,WGS 使用 TITAN 软件得出的 HRD 评分更接近参考值。
为了揭示 HiSNP Ultra panel 和 WGS 之间 CNV 和 LOH 检测的差异,统一使用 sequenza 软件来检测标准品的 ASCN(图3.C)。结果表明,HiSNP Ultra panel 对低 HRD 样品的重现性高(≥94%),对高 HRD 样品相对较低,但总体再现性仍超过90%。
为了研究捕获区域的同质性对 ASCN 和 HRD 的影响,将整个基因组分成 3Mb 的片段并计算每个区域标准品的杂合位点的数量。如图3.D 所示,HiSNP Ultra panel 捕获的杂合位点的数量主要为 22-24/3Mb,而 WES 的数量为0-4/3Mb。此外,由于肿瘤标准品中存在多个 LOH,其杂合位点的数量少于对照样本。这意味着 HiSNP Ultra 可以准确地反映肿瘤和对照样本之间杂合位点的差异,从而比 WES 更能提高 ASCN 和LOH 的检测效率。
当面对低纯度样品时,捕获 panel 和分析工具的检测能力均受到挑战。为此进行了纯度模拟分析,以验证 HRD 分析与肿瘤细胞纯度之间的关系。结果表明,在肿瘤纯度按百分比线性增长情况下,当肿瘤纯度超过 30% 时,肿瘤标准品的倍性和 HRD 值趋于稳定(图3.E)。
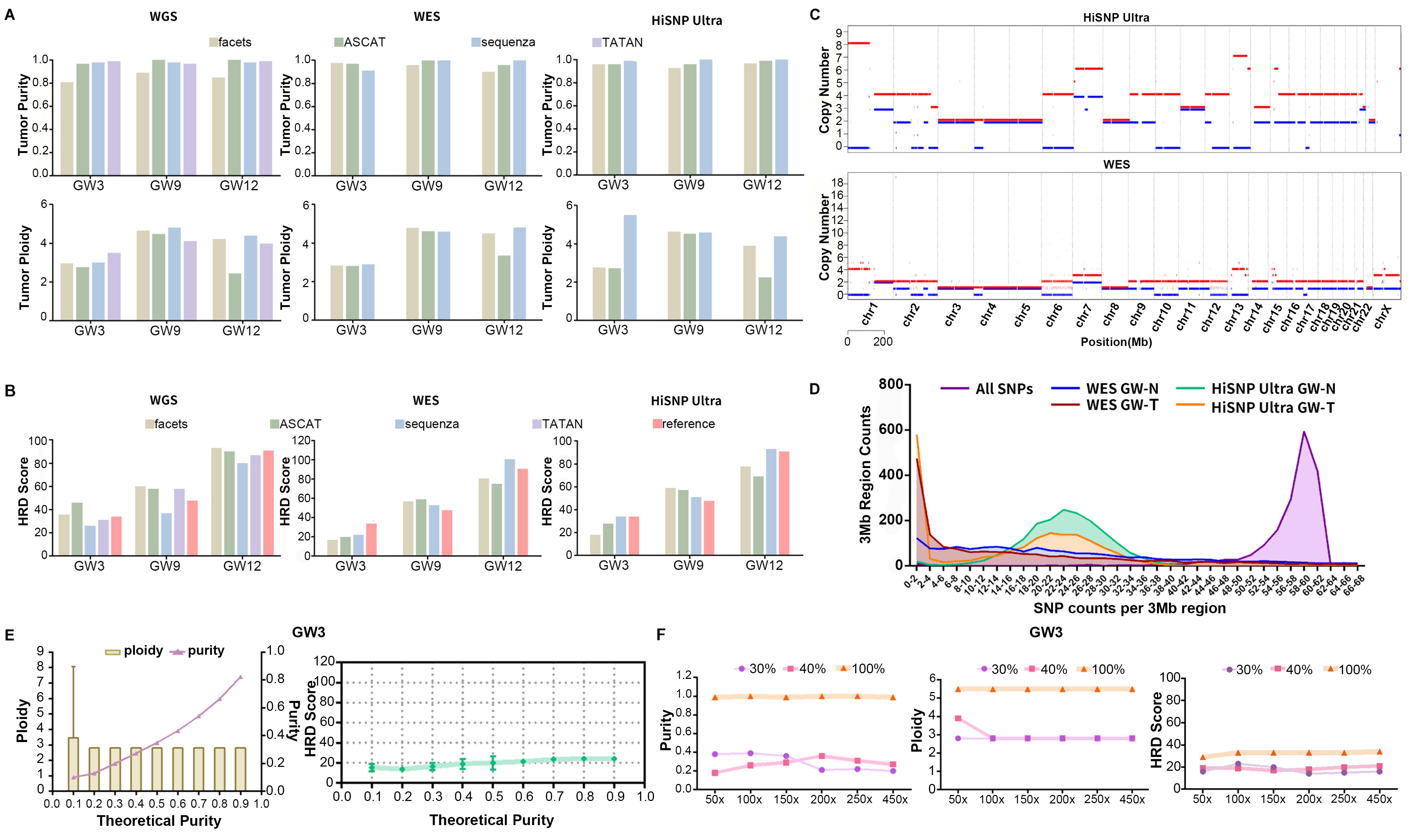
图3. HiSNP Ultra Panel 对 GW 标准品的评估
表3. 标准品HRD评分
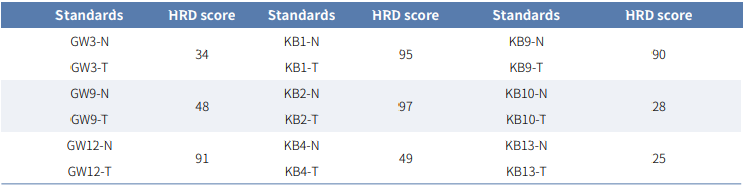
为进一步验证 HiSNP Ultra panel 跟高深度 WGS 检测HRD 性能的一致性,文中使用 ICGC 数据库中深度超过 30X的 70 个卵巢癌WGS数据集作为参照。同时对 HiSNP Ultra panel 降低分辨率后,模拟出的两个低分辨率的 HiSNP panel:9000 个 SNP 的 HiSNP panel(300 kb 分辨率)和27000 个 SNP 的 HiSNP Plus panel(100 kb 分辨率)。然后将上述 WGS 与 HiSNP、HiSNP Plus 和 HiSNP Ultra panel 一同进行 CNV 和 HRD 评分分析。结果表明,所有三个 panel都具有相当的 CNV 检测能力(图4.A)。然而,在 HRD 检测方面,HiSNP Ultra panel 和 HiSNP Plus panel 跟 WGS 检测的 HRD 结果非接近,且优于 HiSNP panel(图4.B)。

图4.HiSNP、HiSNP Plus 和 HiSNP Ultra panel 与 WGS 的比较
有证据表明,SNP 芯片在 CNV 检测方面仍优于 WES,同时 NGS 靶向捕获的策略可以探明芯片检测中易缺失的微小或新拷贝数变体。因此,文中比较了 HiSNP 系列 panel 和SNP 芯片之间 CNV 检测的性能,并发现 HiSNP Ultra panel 对 CNV 检测与 SNP 芯片一样敏感(图5)。结果表明,在HRD 分数较低的样本中,三个 panel 具有相似的性能。然而,在具有中等或高 HRD 值的样本中,HiSNP Plus 和 HiSNP Ultra 结果高于 HiSNP,更接近参考值(图6.)。这也表明了对于 HRD 的检测,接近 3 万个 SNP 位点就可能已经足够了。
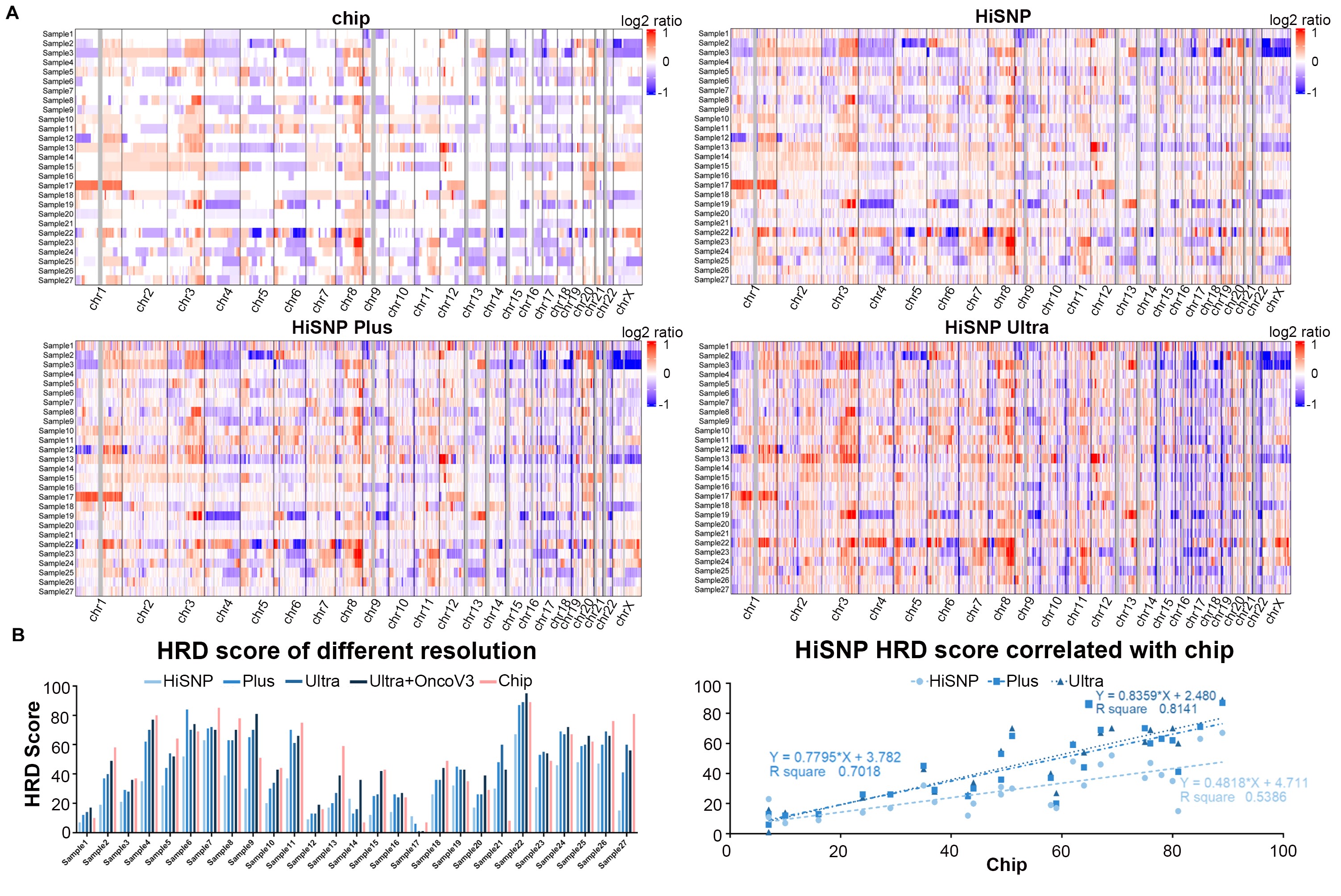
图5.HiSNP、HiSNP Plus 和 HiSNP Ultra panel 与 Chip 的比较
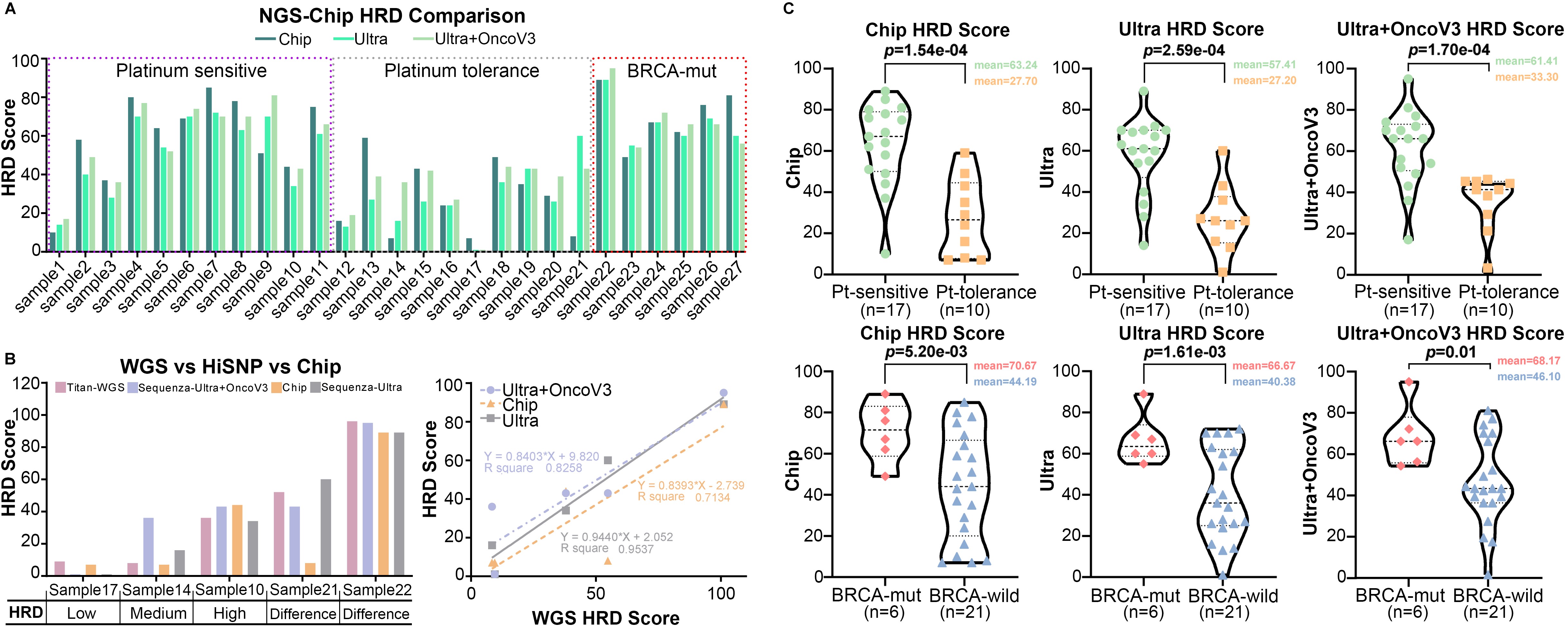
图6.HiSNP-Ultra panel 对临床卵巢癌症组织的性能测试
为同时检测真实样本中 HRD 与 HR 基因突变的情况,除HiSNP Ultra panel 外,文中使用 HiSNP-Ultra-NanOnco Plus V3 混合 panel (该 panel 针对 600 多个癌症相关基因,包括 35 个 HR 基因)对 27 例真实肿瘤样本进行捕获测序。结果显示,6 个样本中发现 BRCA1/2 突变,且其 HRD 评分均高于中位数,同时各 HRD 评分铂敏感度基本一致(图6.)。由此,文中认为当同时需要 HRD 评分和基因突变分析时,HiSNP Ultra panel 和外显子 NGS panel 的组合是可行的选择。
总结
这项研究结果显示,HiSNP Ultra panel 与任何报道的基于 SNP 的 HRD panel 相比,其具有更少的 SNP 位点,且更适合中国患者。与 WGS 及 Chip 相比,其检测 HRD 的结果具有相当的一致性,略优于 WES panel。此外,它还可以与常规外显子基因 panel 配合使用,以全面检测基因组突变和 CNV,具有指导 PARPis 或铂基治疗临床的潜力。
订购信息
|
产品类型 |
产品名称 |
货号 |
|
文库构建模块 |
NadPrep® DNA Library Preparation Kit (for Illumina®), E96 |
1002103 |
|
杂交试剂 |
NadPrep® Hybrid Capture Reagents, 96 rxn |
1005101 |
|
通用封闭 |
NadPrep® NanoBlockers (for Illumina®), 96 rxn |
1006102 |
|
捕获试剂盒 |
HiSNP Ultra Panel V1.0 |
1001831 |
|
捕获试剂盒 |
NanOnco Plus Panel V3.0 |
1001111F |
|
捕获试剂盒 |
Exome Plus Panel V2.0 |
1001841 |
关于纳昂达科技
http://www.njnad.com/
纳昂达科技秉承“ Nano Trans More ”的核心理念和“靶向精准,用心服务诊断”的奋斗宗旨,致力于为科研院校、医疗机构、临检单位、产业公司、测序服务商等提供专业化和高质量的靶向测序产品与闭环解决方案。
纳昂达科技已通过高新技术企业、江苏省科技型中小企业和南京市精准高通量测序工程技术研究中心认定,并拥有 > 2,000 平米的高通量测序研发中心和 > 4,000 平米的GMP级别 (YY/T 0287-2017 idt ISO 13485:2016) 体外诊断试剂生产基地,建立了从市场调研、产品设计、生产制造到售后服务完整的质量管理体系。
纳昂达专注于精准靶向试剂和配套自动化仪器的开发、生产、销售和服务,目前拥有 MGI 和 Illumina 双测序平台多款 NadPrepⓇ 文库构建试剂盒和全套液相杂交相关产品。明星产品包括 NGS 全流程自动化工作站、肿瘤全外显子 Panel、泛实体瘤和血液肿瘤Panel以及呼吸道病毒 Panel 等,并提供全面完善的双平台捕获探针定制化服务。纳昂达科技的靶向捕获产品拥有与国际同行业媲美的高质量水准,获得了客户一致的信赖。
纳昂达的销售网络覆盖全国并已外延至海外地区。纳昂达将与客户共成长,对客户的需求全力以赴,为全球用户提供靶向测序解决方案和 IVD 试剂原料。

电话:400 871 7699
邮箱:sales@njnad.com
网址:www.njnad.com
参考文献
[1] Ferlay J, Colombet M, Soerjomataram I, et al. Estimating the global cancer incidence and mortality in 2018: GLOBOCAN sources and methods[J]. International journal of cancer, 2019, 144(8): 1941-1953.
[2]Torre L A, Trabert B, DeSantis C E, et al. Ovarian cancer statistics, 2018[J]. CA: a cancer journal for clinicians, 2018, 68(4): 284-296.
[3]. Lowe K A, Chia V M, Taylor A, et al. An international assessment of ovarian cancer incidence and mortality[J]. Gynecologic oncology, 2013, 130(1): 107-114.
[4].Boussios S, Moschetta M, Zarkavelis G, et al. Ovarian sex-cord stromal tumours and small cell tumours: Pathological, genetic and management aspects[J]. Critical reviews in oncology/hematology, 2017, 120: 43-51.
[5].Pennington K P, Swisher E M. Hereditary ovarian cancer: beyond the usual suspects[J]. Gynecologic oncology, 2012, 124(2): 347-353.
[6].Li X, Heyer W D. Homologous recombination in DNA repair and DNA damage tolerance[J]. Cell research, 2008, 18(1): 99-113.