不是上火,不是鼻炎!警惕“广东癌”:从晚期诊断到早期预警
新知小课堂
Q 鼻咽癌早期筛查怎么做?
鼻咽癌在我国华南地区的发病率居全球首位,素有“广东癌”之称。在筛查方法方面,血清学检测 EB 病毒特异性抗体是早期发现并诊断鼻咽癌的重要检查手段,目前已广泛应用于临床的抗体包括 VCA-IgA、EA-IgA、EBNA-IgA 等。其次,电子鼻咽镜检查可以直观观察黏膜细微变化,及时发现早期病变和较小的肿瘤,在鼻咽癌早期诊断中具有较高的应用价值。如果在镜检过程中发现可疑病变,则需进一步通过影像学检查 (如 MRI 或 PET/CT) 来明确肿瘤的部位和范围,相比 CT,MRI 对细小和早期病灶的显示更为清晰,而 PET/CT 则具有较高的敏感性和特异性。
尽管上述方法在鼻咽癌早期诊断过程中均具有一定价值,但其单独效益有限,而联合应用能显著提高早期鼻咽癌诊断率。目前,鼻咽癌相关标志物及其检测手段仍在持续探索中,力求筛选出灵敏性和特异性均较高的标志物,并结合快速、简便且可靠的检测手段,实现鼻咽癌的早期诊断,从而进一步提高其早期检出率。
01 背景
鼻咽癌 (Nasopharyngeal carcinoma,NPC) 主要由 EB 病毒 (Epstein-Barr virus,EBV) 感染引发的鼻咽上皮细胞克隆性增殖所致,EBV 感染被认为是肿瘤发生的早期关键事件。尽管早期 (I/II期) NPC 患者预后良好,但晚期 (III/IV 期) 患者仍面临较高的远处转移和复发风险。遗憾的是,由于早期症状不明显,仅有不到 20% 的 NPC 患者能获得早期诊断。因此,开发能够在高发地区人群中实现 NPC 早期检测的生物标志物具有重要意义。
2025 年 5 月 8 日,中山大学肿瘤防治中心联合中国医学科学院苏州系统医学研究所等多家单位在 Cancer Cell (IF = 48.8) 期刊上发表了题为“Immunosequencing identifies signatures of T cell responses for early detection of nasopharyngeal carcinoma”的研究性论文。该研究首次通过大规模 T 细胞受体 (TCR) 免疫组库测序,锁定 NPC 特异性 T 细胞克隆,构建了可提前 6-12 个月预警 NPC 发生的 T-score 模型,并揭示 EBV 与肿瘤抗原双重识别的免疫监视机制,为 NPC 早诊与细胞治疗提供全新策略。本研究采用纳昂达靶向捕获技术方案进行 HLA 分型,为后续研究与分析提供了重要支撑。
02 研究方法
2.1 研究对象与样本来源
● 发现队列:720 例,包含 228 例 NPC 患者,241 例 VCA-IgA 抗体阳性高风险个体对照 (AR),以及 251 例 VCA-IgA 抗体阴性健康人群对照 (PC)。
● 验证队列:
1、病例队列:90 例 NPC 患者;
2、筛查队列:15,796 例,包含 68 例 NPC 患者 (34 例 I/II 期患者)、15,728 例对照 (107 例 ARs 和 146 例 PCs)。
DNA 样本来源于受试者外周血、外周血单核细胞 (PBMC) 或扩增的 T 细胞。
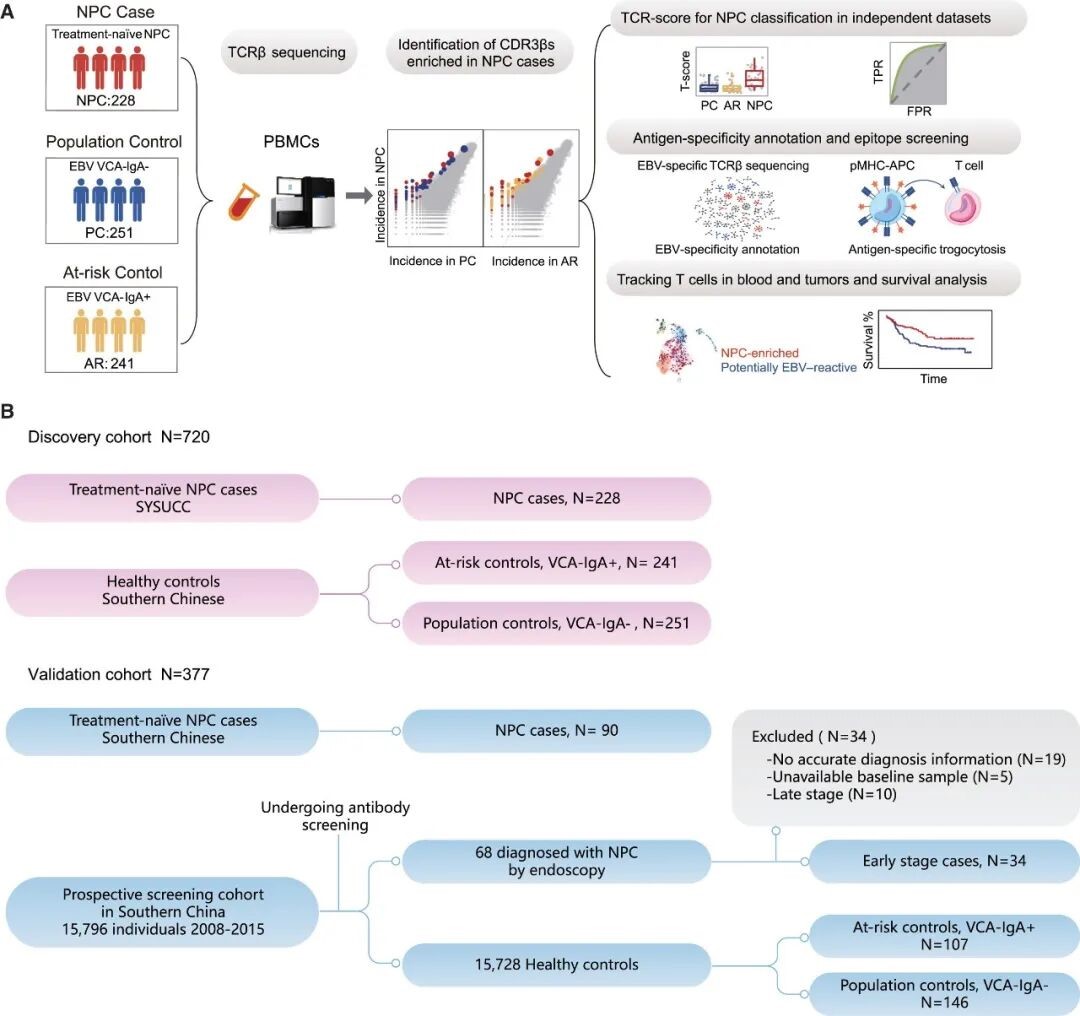
图 1. 研究设计和队列概述。
注:A. 工作流程和分析概述;B. 发现队列和验证队列的组成。
2.2 TCRβ 免疫组库测序
本研究采用两步多重 PCR 策略扩增 TCRβ CDR3 区以构建 NGS 文库,并在 Illumina NovaSeq 6000 (PE150) 平台上进行测序。
2.3 HLA 分型
外周血 gDNA 用于 HLA 分型以确认 MHC-I/II 等位基因频率。其中 421 例样本使用纳昂达高精度 HLA 分型 Panel: HLAtyping Panel v2.0 (Nanodigmbio) 对 11 个等位基因位点 (HLA-A、HLA-B、HLA-C、DPA1、DPB1、DQA1、DQB1、DRB1 以及 DRB3/4/5) 进行基因分型。
03 研究结果
3.1 TCRβ 测序构建“分子雷达”:提前 6-12 个月锁定癌变信号
3.1.1 NPC 富集型 TCRs 鉴定及 T-score 模型构建
研究人员整合了 720 名受试者 (发现队列) 的外周血 TCRβ CDR3 序列的深度测序数据,共筛选出在 NPC 患者中显著富集的 208 条公共 CDR3β 序列 (NPC 富集型 TCRs) (图 2. A)。这些富集序列在 NPC 患者中的发生率和克隆增殖程度显著高于 PCs 及 ARs,且大多使用特定的 V/J 基因,呈现保守的氨基酸序列模式 (图 2. B-C)。进一步比对发现,约半数 NPC 富集型 TCRs 与已知的 EBV 特异性 TCR 序列在氨基酸水平高度相似 (图 2. D)。
为了评估 NPC 富集型 TCRs 的诊断潜力,研究人员基于上述 208 条富集序列构建了 T-score 模型,用以衡量个体 TCR 免疫组库中 NPC 富集型 TCRs 的克隆型丰度 (图 2. E)。在发现队列中,NPC 患者的 T-score 均值 (8.46) 显著高于 PCs (4.43) 和 ARs (3.86) (图 2. F)。与 T-score ≤ 4 的人群相比,T-score > 10 的个体发生 NPC 的风险增加了 35 倍 (95% CI:13.36-102.81) (图 2. G)。T-score 模型在区分 NPC 患者与健康对照组中的表现优异 (AUC = 0.81;95% CI: 0.76-0.86) (图 2. H)。
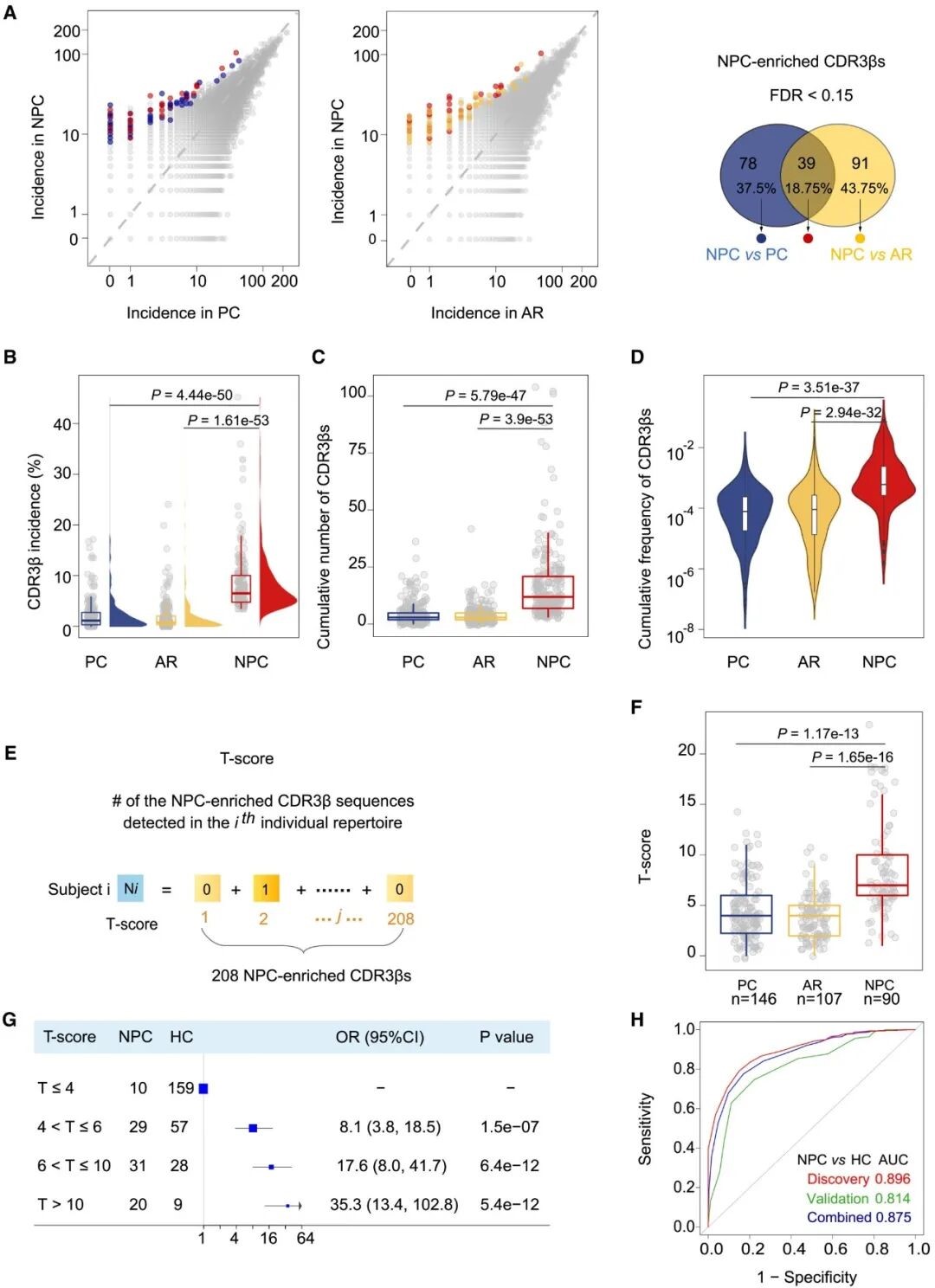
图 2. NPC 富集型 TCRs 的识别及 T-score 构建。
注:A. 在发现队列中筛选出的 NPC富集型 TCRs;B. 富集序列的 V-J 基因使用频率分析;C. 高频富集 TCR 序列的氨基酸同源性聚类分析;D. 与 EBV 抗原特异性数据库的比对分析;E. T-score 构建流程图;F-G. T-score 在发现队列和验证队列中的诊断性能 (ROC 曲线)。
3.1.2 T-score 模型显著提升早期 NPC 检测效能
为了进一步验证 T-score 在 NPC 早期诊断中的能力,研究人员分析了 34 例后续被临床确诊为早期 NPC 患者入组时的基线 T-score。结果表明,基线 T-score 与从入组到确诊的时间间隔呈显著负相关 (图 3. A-B),提示 T-score 可用于 NPC 的早期预警。此外,T-score > 4 的个体从入组到确诊的中位时间仅为 4 个月,显著短于 T-score ≤ 4 个体的 27 个月 (图 3. C),证实其能提前识别高危人群。有趣的是,随着早期 NPC 诊断的临近,T-score 显著升高 (p = 0.003),而 VCA-IgA 抗体的升高则较为微弱 (图 3. D-E)。此外,与抗体检测相比,T-score 在临床确诊前 6-12 个月内的预测准确度明显提高 (AUC > 0.80) (图 3. F)。由此可见,NPC 富集型 TCRs 的 T-score 能够有效区分 NPC 患者与 PCs 及ARs,凸显其作为 NPC 特异性预警标志物的临床应用潜力。
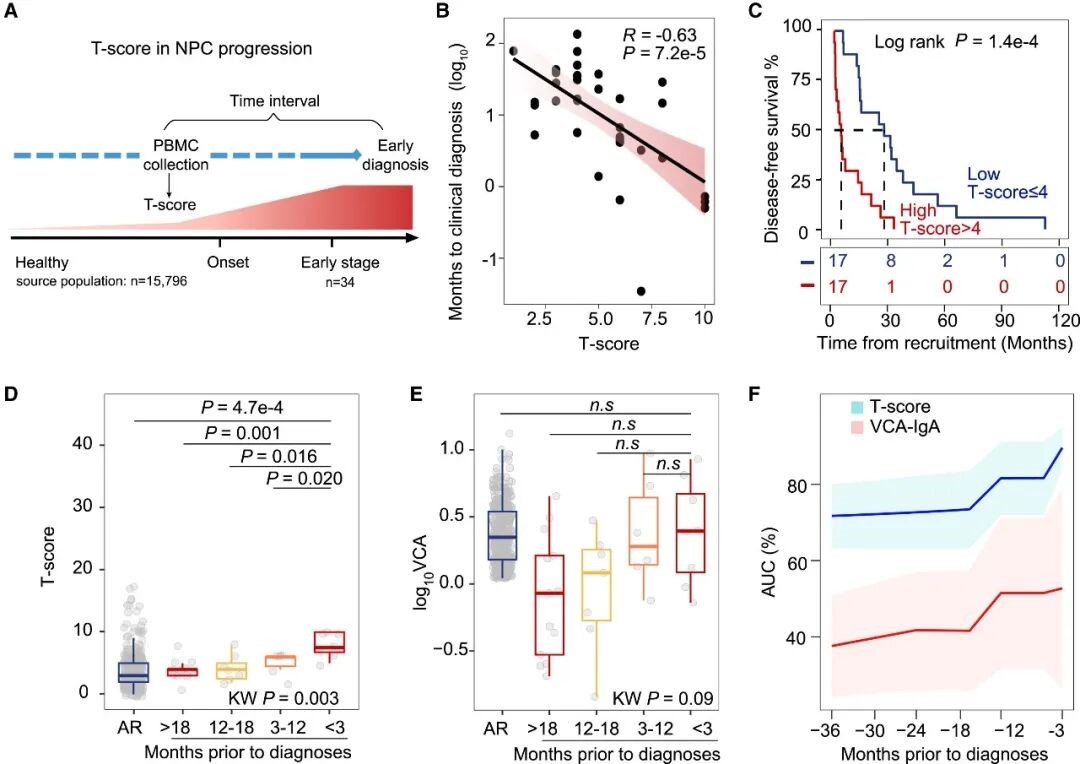
图 3. NPC 富集型 TCRs 特征用于 NPC 早期诊断。
注:A. T-score 评估与 NPC 早期确诊时间间隔;B. T-score 与入组到临床确诊时间间隔的相关性分析;C. Kaplan-Meier 曲线;D-E. 按从基线到临床确诊的时间间隔分层,比较高风险对照 (AR,n = 348) 和前瞻性队列病例 (n = 34) 中 T-score (D) 与 EBV VCA-IgA 水平 (E) 的分布;F. 不同基线至临床确诊时间间隔下,T-score 和 VCA-IgA 的时间依赖性 AUC。实线为点估计,阴影区域为 95% 置信带。
3.2 解码 NPC T 细胞免疫分子机制:病毒、肿瘤双重抗原驱动的 T 细胞应答
3.2.1 NPC 富集型 TCRs 的抗原特异性与 HLA 分子强关联
研究人员通过对来自 19 例 NPC 患者的 PBMC 样本中扩增的 EBV 特异性 T 细胞进行 TCRβ 测序,共鉴定出 633 条潜在 EBV 反应性 CDR3β 序列,同时整合了 VDJdb 数据库中以高置信度(score ≥ 2)筛选的 EBV 反应性 TCRβ,构建了一套参考数据库。利用 GLIPH2 和 GIANA 对其进行聚类分析,共确认了 18 条潜在 EBV 反应性 CDR3β 序列,其中 12 条序列同时获得GLIPH2 和 GIANA 的支持 (图 4. A-B)。此外,研究人员还分析了 1,061 名具有 HLA 等位基因信息的个体中 HLA-TCR 的关联。在 208 条 NPC 富集型 CDR3β 序列中,有 45 条与至少一种 HLA 等位基因表现出显著关联。然而,没有任何 TCR 同时与多于一种 HLA-A/B/C 等位基因相关 (图 4. C)。由此可见,MHC-I 关联均由单一等位基因驱动,从而验证了关联分析的可靠性。
为了进一步阐明 HLA 对 NPC 富集型 CDR3β 序列的影响,研究人员在考虑 HLA 背景的前提下,比对了病例组与对照组中序列的频率差异。分析结果显示,携带特定 HLA 等位基因的 NPC 患者中 NPC 富集型 TCRs 的丰度显著更高 (图 4. D)。由此可见,HLA 驱动的选择压力在 NPC 患者体内促进了与疾病相关的 TCR 富集。
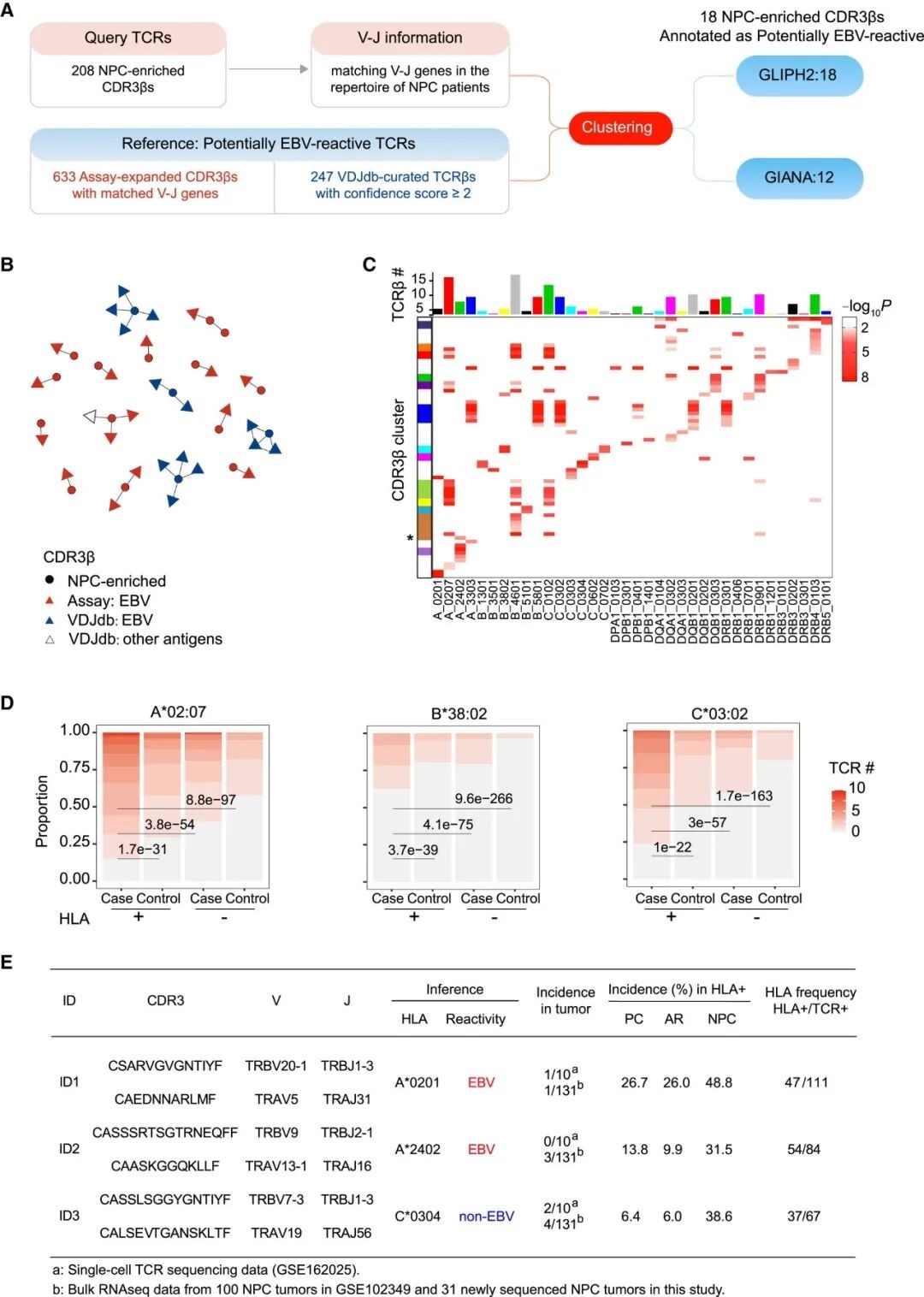
图 4. NPC 富集型 TCRs 的 EBV 抗原识别与 HLA 限制。
注:A. NPC 富集型 TCRs 的 EBV 特异性注释及 GLIPH2 和 GIANA 聚类分析流程;B. NPC 富集型 TCRs 的聚类分析及特异性注释;连线表示这些序列被 GLIPH2 归为同一聚类;C. NPC 富集型 TCRs 与 HLA 关联分析热图;上方柱状条表示与每个 HLA 等位基因显著关联的 TCRβ 序列个数。左侧彩色条表示共有 CDR3β 的 TCRβ 聚类。星号标注的 CDR3β 在使用不同 TRBV 基因时与不同 HLA 等位基因相关;D. 携带特定 HLA 等位基因阳性 (+) 或阴性 (-) 的 NPC 患者和健康对照者中,HLA 相关 NPC 富集型 TCRβ 序列的携带数量分析堆叠图;E. 用于功能验证的三对 NPC 富集型 TCRɑ/β 全长序列信息。
3.2.2 NPC 富集型 TCRs 同时识别病毒和肿瘤相关抗原
为了进一步验证 NPC 富集型 TCRs 的功能及其对 EBV 抗原的反应性,研究人员从 208 条 NPC 富集型 TCRs 序列筛选出三条具备完整 α/β 链信息、在血液及肿瘤中高频出现、并与特定 HLA 等位基因显著相关的 TCRs:TCR-ID1、ID2和ID3 (图 4. E)。其中,ID1 与 ID2 分别与 HLA-A*02:01 和 HLA-A*24:02 相关,且推测具有 EBV 反应性;ID3 则与 HLA-C*03:04 相关,但未显示 EBV 特异性 (图 5. A-C)。通过功能性研究验证,两条 TCR 特异性识别 EBV 蛋白 BMLF1/LF1/BFRF3 的全新抗原表位,其中一条更具备交叉识别能力,介导对 EBV 阳性肿瘤细胞的杀伤;另一条 TCR 则靶向非病毒来源的 NPC 相关肿瘤抗原,首次证实 NPC 中存在病毒与肿瘤抗原的双重免疫监视网络 (图 5. D-K)。
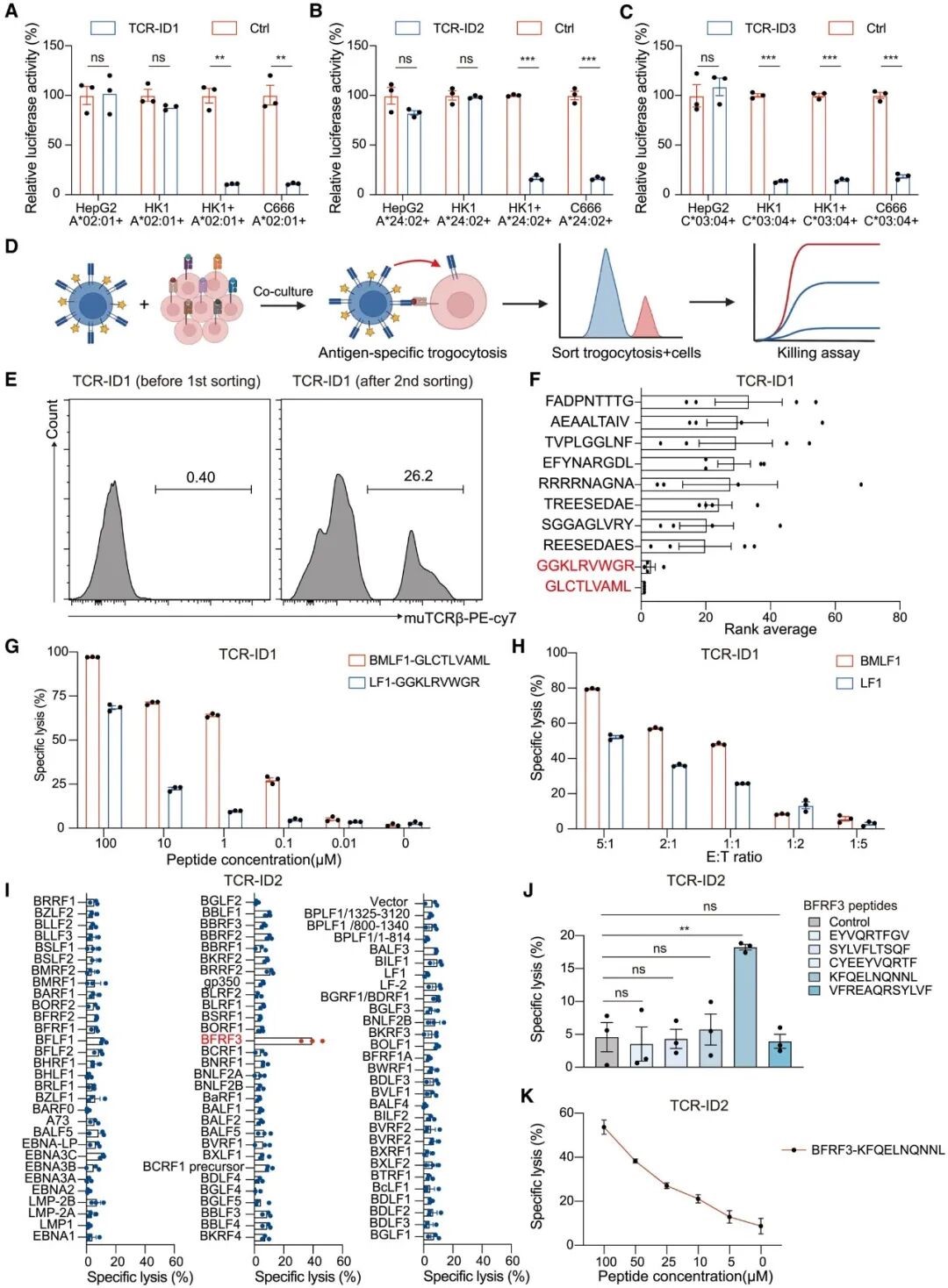
图 5. NPC 富集型 TCRs 同源表位的鉴定。
注:A-C. 通过检测存活靶细胞的荧光素酶活性对 TCR 介导的细胞毒性进行评估;D. 基于胞吞作用的同源表位鉴定示意图;E-F. 经两轮胞吞作用筛选后通过 NGS 鉴定到的富集肽段序列;G-K. 特异性抗原识别验证。
04 总结与展望
本研究通过大规模 TCR 测序,筛选出 208 条在 NPC 患者中显著富集的 CDR3β 序列,并据此构建了 T-score 模型。该模型可在临床确诊前 6-12 个月有效识别 NPC,尤其适用于高风险人群早期筛查。与抗体检测相比,T-score 模型具更高特异性与预测价值,凸显临床应用潜力。进一步研究发现,NPC 富集型 TCRs 不仅可识别 EBV 抗原,还可识别非 EBV 来源的肿瘤抗原,并与特定 HLA 等位基因呈显著关联。免疫组库分析结合功能验证揭示了 NPC 中可供开发的“病毒-肿瘤”双靶点免疫图谱,为拓展 HLA 限制性、构建多靶点 TCR-T 细胞免疫疗法提供了新方向。
此外,外周血中的 NPC 富集型 T 细胞克隆与肿瘤组织高度重叠,表明外周血可作为肿瘤反应性 T 细胞来源。随着 TCR 测序技术发展,外周血 T 细胞有望成为“分子预警网络”,推动肿瘤防治向超早期干预和精准免疫治疗迈进。由此可见,NPC 富集型 TCRs 不仅在疾病监测方面具有重要价值,还展现出广阔的免疫治疗应用前景。