无需转化 超灵敏的甲基化与突变共检方案来了!
癌细胞中的 DNA 异常甲基化贯穿于癌症发生和发展的全过程。与传统的肿瘤标志物相比,DNA 甲基化标志物具有更早期、更无创、更精准等优点。因此,可以通过甲基化标志物检测辅助癌症早期诊断,评估进展风险,评估肿瘤微小残留病灶 (MRD) 和监测复发,还可作为化疗敏感性的标志,更好地指导治疗方案[1-5]。
01 甲基化转化:多组学分析的“拦路虎”
DNA 甲基化的检测通常需要经过转化处理,主流技术包括基于化学试剂的亚硫氢酸盐 (BS) 转化和基于酶法的温和转化。
基于化学试剂的 BS 转化技术通过 BS 处理 DNA,将 DNA 中未甲基化的胞嘧啶 (C) 转化为尿嘧啶(U),经过 PCR 扩增后进一步变成胸腺嘧啶 (T),而原本甲基化的 C 保持不变,最后通过测序后对 DNA 序列的分析以区分不同的甲基化状态。虽然,亚硫酸氢盐转化时间短,速度快,转化效率高,但转化过程中剧烈的温度和 pH 变化会导致 DNA 降解和断裂,因此,尽管 BS 转化法被誉为 DNA 甲基化检测的“金标准”,它更适用于起始量较高的样本。
基于酶法的温和转化技术相对温和,避免了 DNA 降解和断裂,但操作繁琐,反应时间长,且转化效率不如化学法稳定,仍需进一步优化。
基于 NGS 平台的 DNA 甲基化检测通量高,适用于单癌种、多癌种或泛癌种的检测。然而,受限于 ctDNA 样本的起始量低,并且需同步进行突变检测,多组学分析的操作复杂且成本较高 (图 1.)。市面上常见的“先建库后转化”或是“先转化后建库”的文库转化策略,均难以达到理想效果。
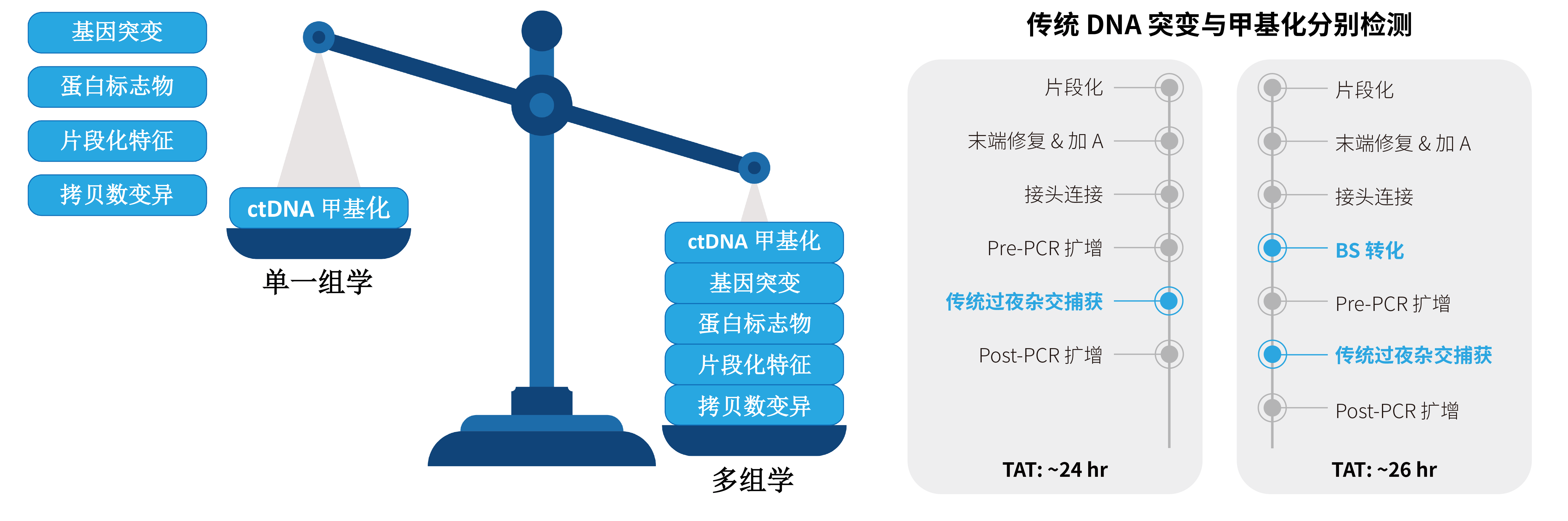
图 1. 甲基化与突变分别检测的传统富集技术方案流程
如何通过单一、有限的样本实现甲基化与突变信号的共检测,既能便捷式操作,又能充分保留原始模板信息,实现更高灵敏度,是目前液体活检技术多组学分析中亟待攻克的难题。
02 无需序列转化的甲基化与突变共检测
基于甲基化敏感的限制性内切酶 (MSRE) 技术利用 MSRE 无法切割位点中甲基化修饰序列的原理,无需对序列进行转化。因此,需要的起始样本要求低,比对效率高,非常具有发展潜力[6]。

结合 MSRE 技术和独家专利的超灵敏探针杂交捕获系统 (μCaler® Hybrid System),纳昂达即将正式推出无需序列转化的超灵敏甲基化与突变共检测全流程解决方案 (μCaler® DNA Full Screen System)。该方案仅需 1 份起始样本 + 1 个杂交反应 + 1 套捕获探针即可实现超高灵敏的全景式甲基化与突变共检!
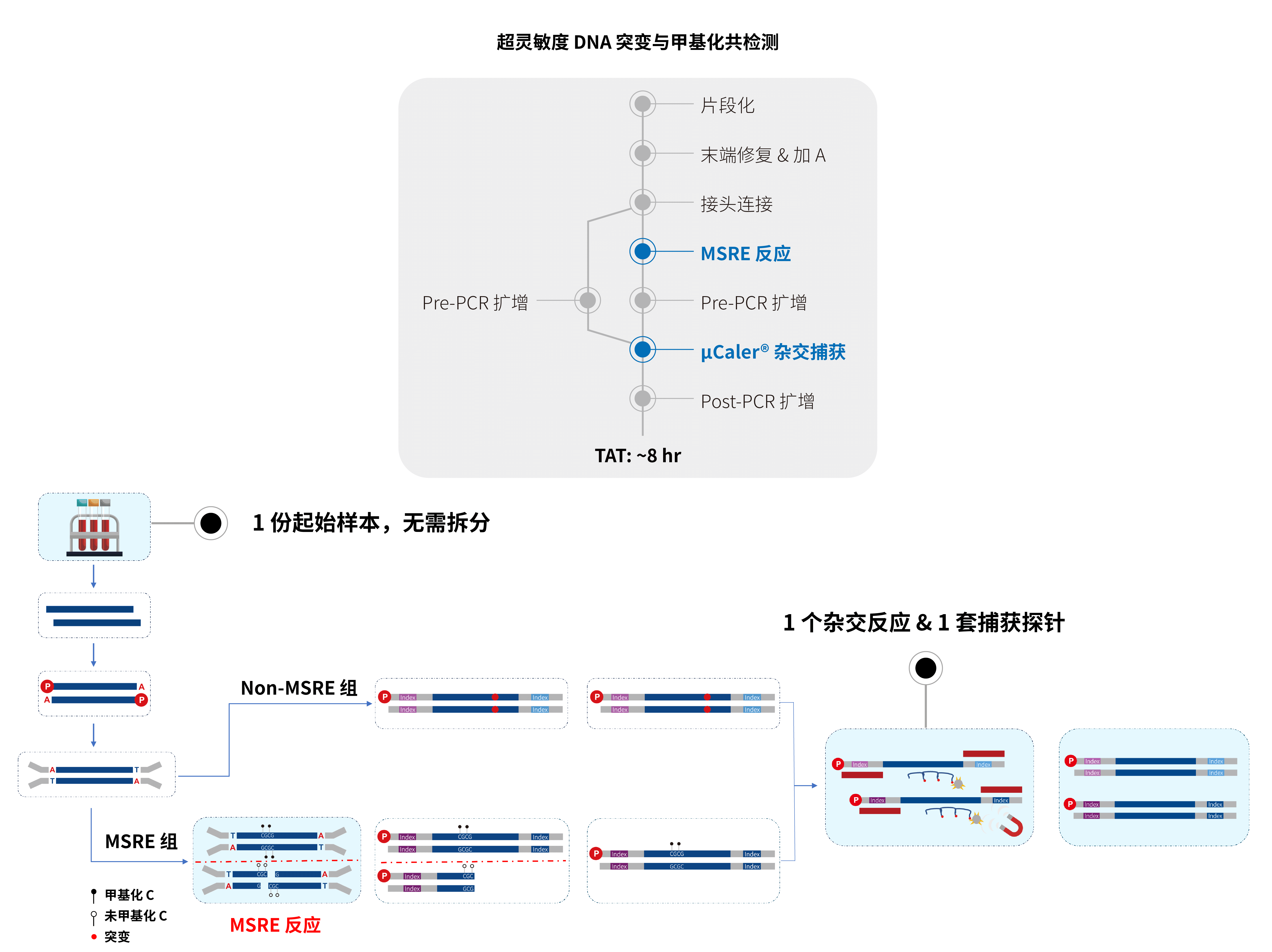
图 2. μCaler® DNA Full Screen System 高效实现甲基化与突变信号共检测
03 μCaler® DNA Full Screen System
方案特色
• 提升模板利用率:摒弃传统 BS 转化方案,充分保留原始信息丰富度,提升数据利用率;
• 单流程多组学分析:仅需 1 份样本,通过 1 个杂交反应和 1 套捕获探针即可实现多组学分析;
• 高速便捷:简便快速的工作流程,单日内高效完成甲基化与突变信号同时检测;
• 联合分析捕捉弱信号:提升低丰度甲基化与超低频突变信号的检测灵敏度;
• 稳定性高:捕获效率和稳定性更高,覆盖更均一;
• 创新性强:自主知识产权的探针设计方案,具有核心竞争力;
• 端到端全流程解决方案:全线覆盖建库、杂交捕获及生信数据分析,提供专业的探针设计以及个性化的生信分析方案。
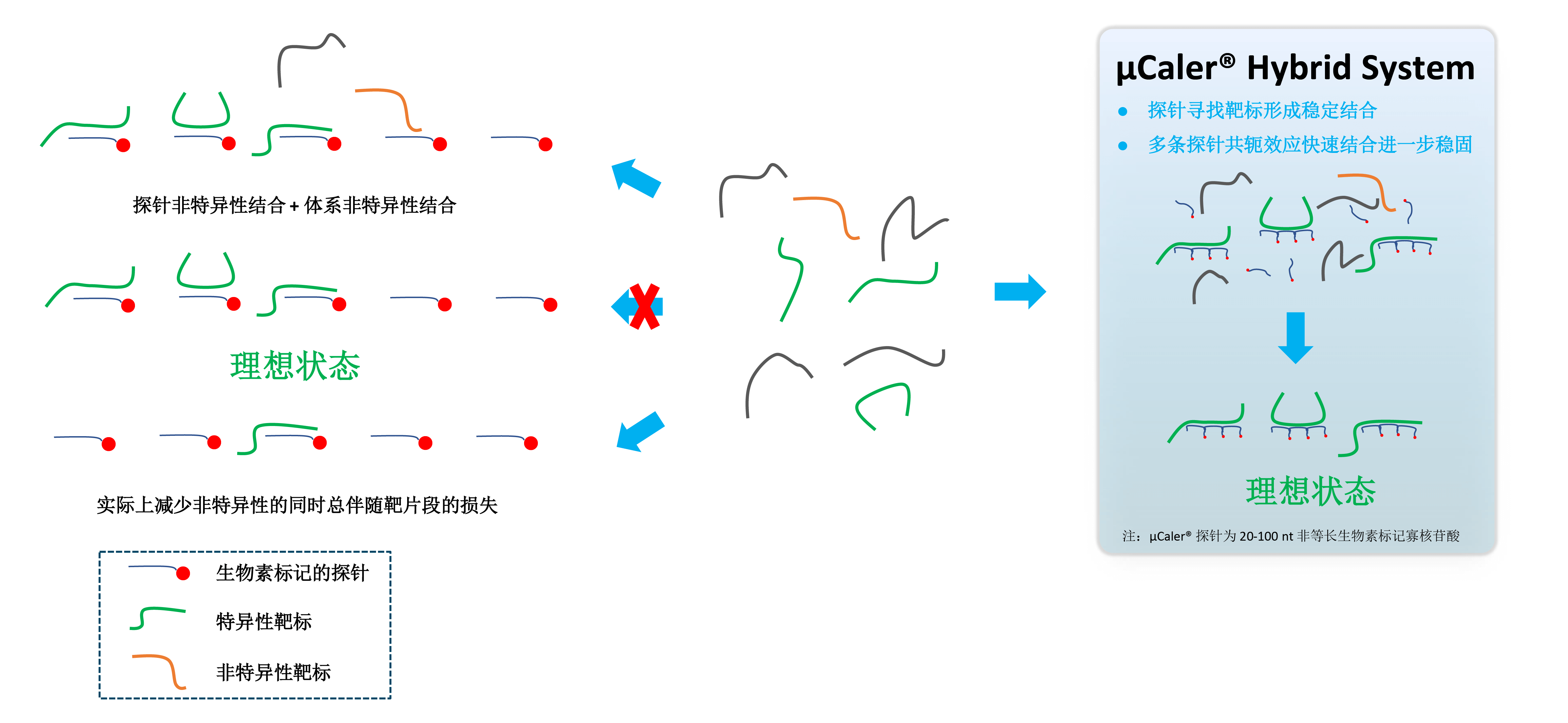
超灵敏探针杂交捕获系统 (μCaler® Hybrid System)
与传统液相杂交捕获技术相比,纳昂达全球独家专利的 μCaler® Hybrid System 采用非等长探针 (20-100 nt),通过探针之间的共轭效应,加强相邻探针对目标区域的富集能力,可更高效稳定地捕获样本中的甲基化与突变信号,实现多组学分析。
我们将在后续篇章中展示更多超灵敏甲基化与突变共检测全流程解决方案 (μCaler® DNA Full Screen System) 的应用案例和表现,敬请关注!
参考文献
[1] Papanicolau-Sengos A, Aldape K. DNA methylation profiling: an emerging paradigm for cancer diagnosis[J]. Annual Review of Pathology: Mechanisms of Disease, 2022, 17(1): 295-321.
[2] 廖乐恩, 潘志忠. 结直肠癌精准外科的综合诊疗[J]. 中国癌症防治杂志, 2023, 15(4): 361-369.
[3] Jin S, Zhu D, Shao F, et al. Efficient detection and post-surgical monitoring of colon cancer with a multi-marker DNA methylation liquid biopsy[J]. Proceedings of the National Academy of Sciences, 2021, 118(5): e2017421118.
[4] Shen S Y, Singhania R, Fehringer G, et al. Sensitive tumour detection and classification using plasma cell-free DNA methylomes[J]. Nature, 2018, 563(7732): 579-583.
[5] Vessies D C L, Schuurbiers M M F, van der Noort V, et al. Combining variant detection and fragment length analysis improves detection of minimal residual disease in postsurgery circulating tumour DNA of stage II–IIIA NSCLC patients[J]. Molecular oncology, 2022, 16(14): 2719-2732.
[6] 中国抗癌协会肿瘤标志专业委员会. 肿瘤 DNA 甲基化标志物检测及临床应用专家共识 (2024 版)[J]. 中国癌症防治杂志, 2024, 16(2): 129-142.







