Ext-RNA Control Panel
#1001651 (96 rxn)
ERCC(External RNA Controls Consortium)是由美国国家标准与技术研究院(National Institute of Standards and Technology,NIST)发起开发的序列和浓度己知的外源标准 RNA 转录本。这些转录本序列主要从随机特异序列中生成,在包括人类在内的多个模式生物数据库中未找到同源序列。
Ext-RNA Control Panel v1.0 靶向 92 条ERCC转录本中的 24 条,长度范围为:273-2,022 bp;其在 ERCC RNA Spike-In Mix 1(Life Technologies,Part no. 4456740)中的浓度范围为:0.014305-937.5 attomol/μl。此 24 条 ERCC 可为 RNA 表达定量提供参考。
- 产品详情
- 产品组分
- 常见问题
- 订购信息
- 资料下载
产品列表
表1. ERCC ID 号及其对应浓度和转录本长度
|
ERCC ID |
浓度
(attomol/μL) |
长度
(bp) |
ERCC ID |
浓度
(attomol/μL) |
长度
(bp) |
ERCC ID |
浓度
(attomol/μL) |
长度
(bp) |
|
ERCC-00057 |
0.014305 |
1,021 |
ERCC-00058 |
1.831055 |
1,136 |
ERCC-00170 |
14.64844 |
525 |
|
ERCC-00017 |
0.114441 |
1,136 |
ERCC-00077 |
3.662109 |
743 |
ERCC-00084 |
29.29688 |
994 |
|
ERCC-00016 |
0.228882 |
844 |
ERCC-00150 |
3.662109 |
273 |
ERCC-00025 |
58.59375 |
1,994 |
|
ERCC-00156 |
0.457764 |
494 |
ERCC-00034 |
7.324219 |
844 |
ERCC-00071 |
58.59375 |
642 |
|
ERCC-00158 |
0.457764 |
1,027 |
ERCC-00085 |
7.324219 |
1,019 |
ERCC-00112 |
117.1875 |
1,136 |
|
ERCC-00109 |
0.915527 |
536 |
ERCC-00157 |
7.324219 |
1,019 |
ERCC-00092 |
234.375 |
1,124 |
|
ERCC-00137 |
0.915527 |
537 |
ERCC-00059 |
14.64844 |
1,023 |
ERCC-00042 |
468.75 |
1,023 |
|
ERCC-00033 |
1.831055 |
2,022 |
ERCC-00126 |
14.64844 |
1,118 |
ERCC-00108 |
937.5 |
1,022 |
实验流程

图1. RNA 靶向捕获流程。
产品表现
ERCC 标准曲线

图2. ERCC 标准曲线。建库时添加 ERCC 标准品,在 RNA-Seq 或 RNACap 中,ERCC RPKM(Reads Per Kilobase per Million mapped reads)与样本浓度间呈现良好的线性关系;RNACap 与 RNA-seq 相比表现出明显的靶基因富集。
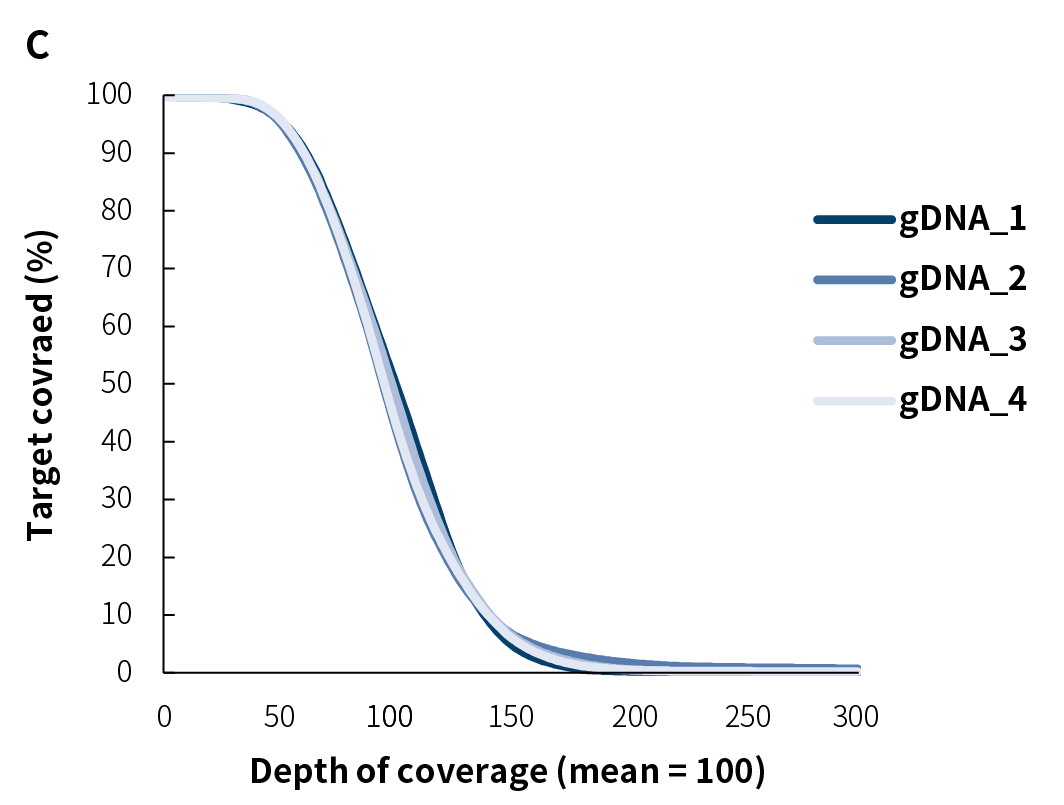
对 ERCC 基因的覆盖分析

图3. ERCC 基因覆盖分析,不同建库方式对 ERCC 基因的覆盖无显著差异,RNACap 未表现出明显偏好性。 RNACap(蓝色):将总 RNA 反转成双链 DNA 后进行靶向建库测序;rRNA-depleted(橙色):对总 RNA 进行去除 rRNA 处理,反转成双链 DNA 后进行建库测序;Total RNA(深蓝):直接将总 RNA 反转成双链 DNA 并进行建库测序。
Spike-in 至不同 panel 中的重复性表现

图4. Ext-RNA Control Panel v1.0 Spike-in 至不同 panel 后的重复性表现。将 Ext-RNA Control Panel v1.0 Spike-in 至 NanOnco Plus Panel v2.0(大 panel)或 NanOnCT Panel v1.0(小 panel),捕获测序后对二者的 ERCC RPKM 的 log 值进行相关性分析。
本产品仅限研究使用,不用于临床诊断。
|
货号 |
管盖
颜色 |
产品名称 |
包装 体积 |
包装/储存温度 |
|
1001652 |
|
Ext-RNA Control Panel v1.0, 16 rxn |
70 μL |
–20℃ |
|
1001651 |
|
Ext-RNA Control Panel v1.0, 96 rxn |
415 μL |
–20℃ |
推荐如下:
• 对于 Size 分布均一、所需测序数据量相同的文库,一般在文库混杂投入比>50 % 的前提下,推荐 500 ng/文库的投入量,以期提高文库丰富度,降低测序数据的重复率;
• 对于 Size 分布不均一、样本质量差异较大、所需测序数据量不同的文库,一般在文库混杂比>50 % 的前提下,推荐按照摩尔量进行相应比例的混合。
注:1. 混杂投入比=样本进入杂交反应的文库量/样本实际文库构建产出总量*100 %;
2. moles of dsDNA (mol) = mass of dsDNA (g) / ((length of dsDNA (bp) x 617.96 g/mol) + 36.04 g/mol)
目前混合文库的浓缩推荐采用真空浓缩法或磁珠浓缩法,具体操作可参考DNA文库杂交捕获操作指南。相关测试结果表明不同浓缩法的结果基本一致,仅存在轻微GC差异偏好。但真空法更经济、操作简单,而磁珠法则可适配自动化工作站,可根据具体情况进行选择:
|
浓缩方式 |
优点 |
缺点 |
|
真空浓缩 |
操作简便、时间可控、损失低 |
需要真空浓缩仪 |
|
磁珠浓缩 |
无需另购仪器、可适配自动化工作站 |
存在DNA损失且需求试剂量增加、存在GC偏好性 |
捕获终文库得量与许多因素存在相关性,除去实验操作影响外,一般会有以下理论影响因素:样本类型、起始混杂文库总量、Panel 大小、杂交时长、扩增循环数等。为获得良好的实验数据,在满足上机测序所需用量的前提下,应尽量控制捕获后扩增循环数。Illumina®平台在上机测序前会对文库进行指数式扩增的成簇反应,故所需的上机文库总量较低(具体需要根据各测序仪型号以及测序公司要求决定)。对于不同 Panel,可在实验初期参考以下推荐列表,后期再根据具体结果进行调整:
|
Panel大小 |
1-plex (500 ng) |
4-plex (2,000 ng) |
8-plex (4,000 ng) |
12-plex (6,000 ng) |
|---|---|---|---|---|
|
>10 Mb |
10 cycles |
8 cycles |
7 cycles |
6 cycles |
|
1 Mb-10 Mb |
12 cycles |
10 cycles |
9 cycles |
8 cycles |
|
50 Kb- 1Mb |
13 cycles |
11 cycles |
10 cycles |
10 cycles |
|
1 Kb-50 Kb |
14 cycles |
12 cycles |
11 cycles |
11 cycles |
针对纳昂达商品化 Panel,可参考下表进行选择:
|
Panel名称 |
大小 |
混杂 |
Post-Capture 扩增循环数 |
捕获文库产出(ng) |
|---|---|---|---|---|
|
Exome Plus Panel 2.0 |
~46 Mb |
1-plex(500 ng) |
8 |
~70 |
|
12-plex(6,000 ng) |
6 |
~200 |
||
|
NanOnco Plus Panel v2.0 |
~2.6 Mb |
1-plex(500 ng) |
10 |
~120 |
|
12-plex(6,000 ng) |
7 |
~80 |
||
|
NanoHema Research Panel v1.0 |
~1 Mb |
1-plex(500 ng) |
11 |
~70 |
|
12-plex(6,000 ng) |
7 |
~80 |
||
|
NanOnCT Panel v1.0 |
~0.4 Mb |
1-plex(500 ng) |
12 |
~80 |
|
12-plex(6,000 ng) |
8 |
~80 |
||
|
LungCancer Panel v1.0 |
~0.23 Mb |
1-plex(500 ng) |
14 |
~100 |
|
12-plex(6,000 ng) |
11 |
~70 |
捕获终文库得量与许多因素存在相关性,除去实验操作影响外,一般会有以下理论影响因素:样本类型、起始混杂文库总量、Panel大小、杂交时长、扩增循环数等。为获得良好的实验数据,在满足上机测序所需用量的前提下,应尽量控制捕获后扩增循环数。MGI测序平台需要在上机前对文库进行环化,接着再进行滚环式扩增成DNA纳米球(DNA Nanoball)的过程。故所需的上机文库总量高于Illumina® 平台(具体需要根据各测序仪型号以及测序公司要求决定)。根据NadPrep®通用环化试剂盒(for MGI)(货号:1002231)使用说明书V1.0版本描述,环化所需文库推荐投入量至少>1 pmol,因此我们推荐:
• 对于大型Panel的多样本混杂文库,由于可能所测数据量较多,建议至少需要满足>1 pmol的总量(>300 ng);
• 对于大型Panel的少量样本混杂文库,由于后续会与其他文库混合上机测序,所需文库总量可适当降低。但建议混合送测文库总量>1 pmol(>300 ng);
对于小型Panel的混杂文库,由于后续会与其他文库混合上机测序,所需文库总量可适当降低。但建议混合送测文库总量>1 pmol(>300 ng)。
基于上述总量,针对特定类型的Panel,可根据测试结果调整捕获后扩增循环数。针对纳昂达商品化Panel,可参考下表:
|
Panel名称 |
大小 |
混杂 |
Post-Capture扩增循环数 |
捕获文库产出(ng) |
|
Exome Plus Panel 2.0 |
~46 Mb |
1-plex(500 ng) |
8 |
~70 |
|
|
|
12-plex(6,000 ng) |
6 |
~200 |
|
NanOnco Plus Panel v2.0 |
~2.6 Mb |
1-plex(500 ng) |
10 |
~120 |
|
|
|
12-plex(6,000 ng) |
7 |
~80 |
|
NanoHema Research Panel v1.0 |
~1 Mb |
1-plex(500 ng) |
11 |
~70 |
|
|
|
12-plex(6,000 ng) |
7 |
~80 |
|
NanOnCT Panel v1.0 |
~0.4 Mb |
1-plex(500 ng) |
12 |
~80 |
|
|
|
12-plex(6,000 ng) |
8 |
~80 |
|
LungCancer Panel v1.0 |
~0.23 Mb |
1-plex(500 ng) |
14 |
~100 |
|
|
|
12-plex(6,000 ng) |
11 |
~70 |
说明:以上为纳昂达针对gDNA或标准品在16 h杂交时长下的经验循环数及产出。不同实验室因样本类型、实验条件、实验环境不同可能有所差异。
针对NadPrep®系列产品,在文库构建及靶向捕获时的扩增引物如下:
|
接头类型 |
Pre-Capture 扩增引物 |
Post-Capture 扩增引物 |
测序平台 |
|---|---|---|---|
|
NadPrep®UDI Adapter |
NadPrep®Amplification Primer Mix |
NadPrep®Amplification Primer Mix |
Illumina®平台 |
|
NadPrep®M-Adapter / BMI Adapter (SI) |
NadPrep®M-Index Primer Mix (SI) |
M-Amplification Primer Mix (SI) |
MGI平台 |
|
NadPrep®M-Adapter / BMI Adapter (DI) |
NadPrep®M-Index Primer Mix (MDI) |
M-Amplification Primer Mix (DI) |
MGI平台 |
|
NadPrep® Universal Stubby Adapter (UDI) |
NadPrep® Universal UDI-Index Primer Mix |
Amplification Primer Mix Ⅱ |
Illumina®/MGI 平台 |
NadPrep®通用型文库构建试剂盒(96 rxn)已包含 Pre/Post-Capture 的相关引物。其中 Post-PCR 引物均为 Illumina 或 MGI 平台通用引物,也可使用其它同类型产品替代。
为了解除带有生物素标记的文库与链霉亲和素磁珠的结合,可尝试使用以下二者操作之一(或参考 M270 磁珠官方建议):
• 溶于 10 mM EDTA、95% 甲酰胺、pH 8.2 的溶液中,混匀并于 65℃下加热 5 min或 90℃下加热 2 min;
• 溶于 0.1 % SDS,混匀并加热煮沸 5 min。
尽管杂交捕获体系已经过优化,适用于更短时间的杂交。但与 16 h 杂交相比,不同类型的 Panel 随着杂交时长的缩短,在捕获文库总量、捕获效率、覆盖均一性等方面皆存在不同程度的降低,详见下图。相比中大型 Panel(>0.4 Mb),小型 Panel(<0.4 Mb)受到的影响更大。对于有时效性要求的,可对大型 Panel 尝试缩短杂交时间,但不建议将此种情况用于小型 Panel。

|
产品 |
货号 |
|
Ext-RNA Control Panel v1.0, 16 rxn |
1001652 |
|
Ext-RNA Control Panel v1.0, 96 rxn |
1001651 |
我们的工作人员将在1个工作日内与您取得联系。
如果有任何问题,欢迎联系
400 8717 699 或 support@njnad.com。