新品发布 | 全景变异分析 - 620 基因,纳昂达升级版泛癌实体瘤 Panel,正式上线!
单基因热点检测和 NGS 小 Panel 检测能够快速准确应用于 EGFR,KRAS,PIK3CA,BRAF 等明确的靶向用药位点检测。然而,区域和基因数量的限制在一定程度上也限制了全局诊疗方案的制定[1]。在 2020 年,欧洲肿瘤医学会(ESMO)基于 145 种靶向治疗药物,分别使用覆盖 315 个基因和 50 个基因的大、小 Panel(Panel 315 和 Panel 50)评估的结果显示,Panel 50 仅覆盖了 43 个可用药基因,而 Panel 315 则覆盖了 158 个。在各类实体瘤中,Panel 315 覆盖的可用药位点比 Panel 50 平均高出 50% 以上。因此,在已获批和实验阶段的药物中,使用更大的 Panel 检测用药位点可得到实质性获益[2]。
基于靶向捕获测序技术的 MSK-IMPACT(468 基因)和 F1CDx(324 基因)是最早获得 FDA 认证的两款 NGS 大 Panel 产品。紧接着 NantHealth 公司 19,396 基因 Omics Core 以及 Personal Genome Diagnostics 公司 507基因 PGDx Elio Tissue Complete 也相继获得美国 FDA 认证,并且后续又获得了用于 K 药泛实体瘤伴随诊断的许可。从获批情况我们不难发现,NGS 大 Panel 检测在美国已然非常成熟,而随着各相关指南和共识的发布,国内也将逐步走向成熟[3]。
纳昂达 NanOnco Plus Panel v3.0 是一款基于 NanOnco Plus Panel V2.0 的升级产品。该款 Panel 覆盖 620 个与肿瘤靶向治疗、免疫治疗、预后以及化疗相关基因,覆盖约 2.4 Mb 基因组区域。在 v2.0 的基础上,v3.0 的全编码覆盖基因额外增加了 55 个,其中包括与 DNA 损伤修复、同源重组修复、免疫治疗及预后相关的基因,同时也增加了 62 个与靶向药物和化疗敏感性相关的多态性位点(证据等级≥ 2B)等一系列升级。
NanOnco Plus Panel v3.0 通过对不同类型靶区域的优化组合,可同时高效富集单核苷酸变异(SNV)、插入缺失(Indel)、融合、拷贝数变异(CNV)等多种变异信息。对于特殊类型的靶区域,我们进行了针对性的增强设计,比如,在具有高度序列多态性的 HLA 位点,我们采用了独特的多态性探针补充方案,能够以最优的探针组合覆盖数据库中的数万种 HLA 分型,从而保证 HLA 区域的捕获有效性;而针对简单重复的微卫星区域,我们也额外进行了加强,可以保证更稳定的微卫星不稳定评估。
在一定的测序量下,大 Panel 的靶区域覆盖范围和测序深度相互制约,这就要求探针的覆盖尽可能高效地转化为靶区域的覆盖,而靶区域的覆盖更有效地转化为对有意义变异的覆盖。因此,我们进一步提升了靶区域中有临床价值变异的密度;改进的探针设计也增强了实际捕获区域与靶区域之间的贴合度,辅以优秀的中靶率和覆盖均一性,保证了测序数据的高利用率,有助于 NGS 成本的控制。
2020 年,纳昂达发布了 NanOnco Plus Panel v2.0,靶向 578 个基因,探针覆盖 2.6 Mb 区域,其中 565 个基因全 CDS 覆盖,还包括精选的基因融合相关内含子区域、经典微卫星位点等。
2021 年 9 月,纳昂达对探针设计方案进行了全新升级,并发布了全新自主研发的核心版全外显子捕获产品 NEXome Core Panel。相比于前代产品,测序数据利用率得到显著提升(初心在方寸 沉淀炼本事 | 纳昂达 NEXome Core Panel 惊喜登场!)。目前,基于此设计理念,NanOnco Plus Panel 也来到了 v3.0。在 3.0 版中,全 CDS 覆盖的基因个数扩充到了 620 个(含 HLA 基因),且参考了最新的 refseq 基因注释;基因融合、经典微卫星位点、HLA 分型增强等特点继续被保留;并增加了对化疗用药相关位点的覆盖(不同版本的产品特点比较详见表 1)。然而,由于采用了更高效的探针设计,探针覆盖区域并没有增加(仅 2.4 Mb),无需增加测序成本以获得更多数据量。
表 1. 产品特点 v3.0 VS v2.0。
|
产品特点 |
v3.0 |
v2.0 |
说明 |
|
基因数量 |
620 |
565 |
CDS 全覆盖的基因数量 |
|
数据量 |
1 Gb |
1 Gb |
随机选取 1 Gb 数据 |
|
中靶率 |
92.33 |
92.27 |
reads/probe bed |
|
插入片段长度 |
241.74 |
241.39 |
插入片段越长,侧翼覆盖越多,降低靶区域覆盖 |
|
覆盖深度* |
302.77 |
297.44 |
以 shared target 计算的原始覆盖深度 |
|
0.2x mean* |
99.70 |
98.99 |
达到 0.2x 平均覆盖深度的靶区比例 |
|
0.5x mean* |
97.25 |
92.49 |
达到 0.5x 平均覆盖深度的靶区比例 |
|
Fold 80* |
1.33 |
1.43 |
使 80% 碱基达到平均覆盖率所需的额外测序的倍数 |
*在两个版本共有的靶区域比较不同维度。
01
捕获性能
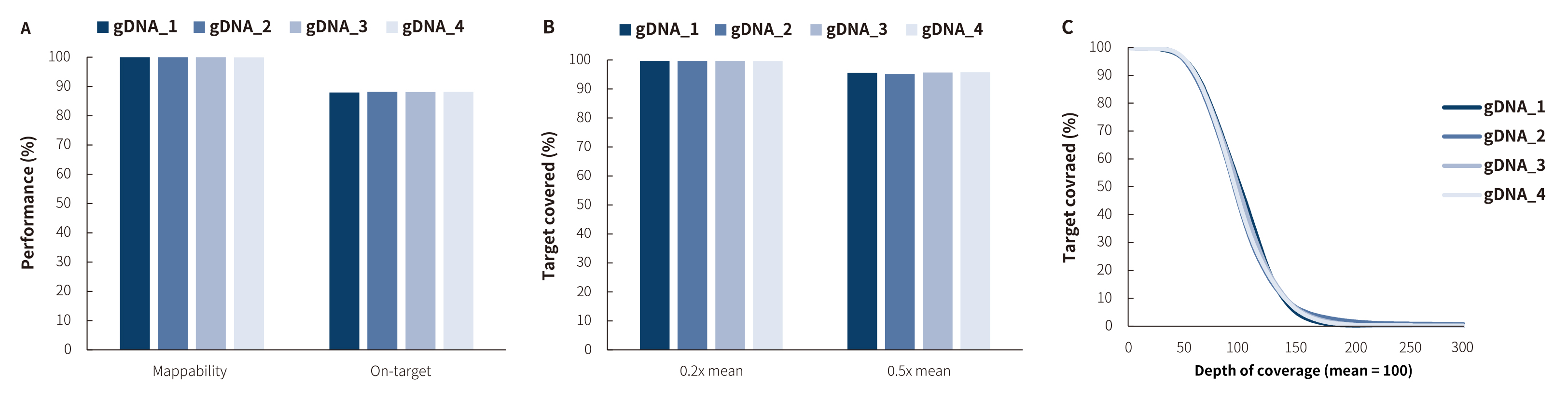
图 1. NanOnco Plus Panel v3.0 对不同 gDNA 文库的捕获表现。
利用 NadPrep® 快速 DNA 酶切文库构建试剂盒搭配 NadPrep® UDI Adapter (for Illumina®) 构建文库,测序模式为 Illumina Novaseq 6000,PE150,利用 BWA 比对到参考基因组 hg38,On-target 按照 reads 数计算。
注:样本 gDNA_1-4 分别为:人类男性基因组 DNA (Promega-male, G1471);肿瘤结构变异 5% gDNA 标准品 (菁良,GW-OGTM001);肿瘤 SNV 1-25% gDNA 标准品(菁良,GW-OGTM004);肿瘤 SNV 野生型 gDNA 标准品 (菁良,GW-OGTM005)。
02
变异检测能力

图 2. NanOnco Plus Panel v3.0 捕获数据中变异频率与标准品标称频率的一致性展示。利用 NadPrep® 快速 DNA 酶切文库构建试剂盒搭配 NadPrep® Universal Stubby Adapter (UDI) 构建文库,测序模式为 Illumina Novaseq 6000,PE150, Vardict 进行变异分析。
注:样本为 Onco Multiplex gDNA (LDTBIO,定制标准品),平均测序深度 3,518x。
表 2. NanOnco Plus Panel v3.0 对其他变异类型检测。
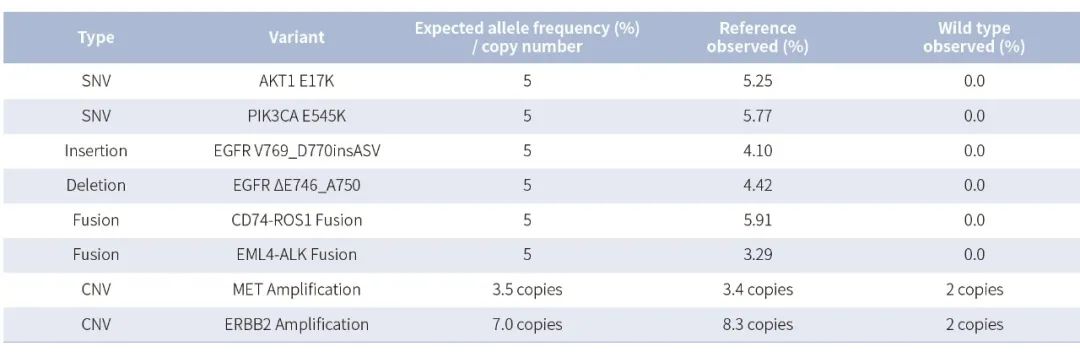
利用 NadPrep® 快速 DNA 酶切文库构建试剂盒搭配 NadPrep® UDI Adapter (for Illumina®) 构建文库,测序模式为 Illumina Novaseq 6000,PE150, Vardict、Delly、CNVkit 分别进行变异分析。GW-OGTM001 的平均测序深度 967x,GW-OGTM005 的平均测序深度 1,126x。
注:样本为肿瘤结构变异 5% gDNA 标准品 (菁良,GW-OGTM001) ,对照为肿瘤 SNV 野生型 gDNA 标准品 (菁良,GW-OGTM005)。
NanOnco Plus Panel v3.0 在捕获和变异检测方面均表现出优异的性能,进一步了解产品详情,请联系纳昂达当地销售或邮件发送至 sales@njnad.com。
|
产品名称 |
货号 |
|
NanOnco Plus Panel v3.0, 96 rxn |
1001111F |
|
NanOnco Plus Panel v3.0, 16 rxn |
1001112F |
关于纳昂达科技
纳昂达科技 成立于 2011 年,秉承 “Nano Trans More ”的核心理念和 “靶向精准,用心服务诊断”的奋斗宗旨,致力于为科研院校、医疗机构、临检单位、产业公司、测序服务商等提供专业化和高质量的靶向测序产品与闭环解决方案。
公司深耕精准靶向领域,目前拥有 MGI 和 Illumina 双测序平台多款文库构建试剂盒和全套液相杂交试剂产品。明星产品还包括全外显子 Panel、泛实体瘤和血液肿瘤 Panel 以及呼吸道病毒 Panel 等,并提供全面完善的双平台捕获探针定制化服务。
面积 > 2,000 平米的高通量测序研发中心和 > 2,500平米的GMP级别(YY/T0287-2017idt ISO13485:2016)体外诊断试剂生产基地为产品创新与生产质量保驾护航。纳昂达的销售网络覆盖全国并已外延至海外地区。
公司将与客户共成长,对客户的需求全力以赴,为全球用户提供靶向测序解决方案和 IVD 试剂原料。
Nanodigmbio

Nanodigmbio
微信公众号 | nanodigmbiotech
参考文献:
[1] Lyle S,Powers W, Jia X, et al. Comparison of a large NGS panel to hot-spot testing andsmall panels for the ability to accurately stratify advanced colorectal cancerpatients to appropriate treatment pathways[J]. Journal of Clinical Oncology,2016, 34(4_suppl):510-510.
[2] Özdemir B,Charrier M, Gerard C L, et al. 7P Comparison of the clinical utility of twodifferent size next generation sequencing (NGS) gene panels for solidtumours[J]. Annals of Oncology, 2020, 31: S1219.
[3] 北京市临床检验中心,北京医学会检验医学分会,首都医科大学临床检验诊断学系,等. 高通量测序技术临床检测规范化应用北京专家共识(第一版通用部分)[J]. 中华医学杂志,2019, 99(43):3393-3397.







