病原合理用药的关键:耐药与毒力基因检测示例分析
01 背景
抗生素的过度使用会导致耐药菌株数量增加,从而严重影响公众健康。但是对耐药性进行正确评估通常很难进行,这是由于抗菌敏感性测试 (AST) 需要先分离培养物中的细菌病原体,这一过程可能需要持续数天且丰度较低。与此同时,在缺乏确定的微生物耐药诊断的情况下,临床治疗用药又依赖于经验。这会导致更广泛的抗生素过度使用,加剧临床耐药的困境。
为了控制抗生素滥用和快速指导病原体感染正确合理用药,高效准确的临床检测手段显得愈发重要。mNGS 和 tNGS 能在一次测序中同时测定许多病原体的基因序列,包括细菌、病毒、真菌等在内的整个微生物群落的基因组构成,有助于快速确定致病微生物及相关耐药基因,非常有望能落实在包括呼吸道感染在内的临床实践中。mNGS 检测方法难以排除人源基因背景,尤其是在呼吸道和其他临床体液中,病原体耐药和毒力基因的丰度本身较低,使得 mNGS 的耐药灵敏度检测受限并且成本高昂。tNGS 可针对低丰度序列靶向富集,由此识别病原体和相关耐药基因,灵敏度更高[1-4]。
纳昂达推出的 tNGS 靶向捕获方案:NEX-t
Panel v1.0,既能用于鉴定病毒、细菌、真菌、寄生虫等数百种病原,也适用于相应的耐药和毒力分析(新品上线 | NEX-t Panel:更精准、更经济的 tNGS 病原检测方案)。在本文中,我们将重点展示 NEX-t 应用于病原微生物耐药基因和毒力基因检测的结果,并与 mNGS 的结果进行对比分析。
02 材料方法
2.1 样本
所有样本均来源于 21 例被确诊为潜在病原体感染患者。样本类型包括:组织、尿液、血液、脓液、伤口、脑脊液、肺泡灌洗液、痰液、宫腔分泌物和未知等。
2.2 实验流程
21 例样本均经由纳昂达 NadPrep®️ 快速 DNA 酶切文库构建试剂盒 v2 构建预文库,之后使用 NEX-t Panel v1.0 捕获获得终文库并在 Illumina 平台测序,测序模式为 PE150。同批次提取的 DNA 样本均平行委托给第三方进行多重 PCR 测序 (SE50) 和 mNGS (SE100),并依据相应的病原体检测报告进行对比分析。
2.3 数据分析
病原微生物分析、耐药基因和毒力基因分析均经由纳昂达自行开发的生信工具:NEX-Tscan 进行。在部分对比分析中,模拟 SE100 和 SE50 的数据集通过对原始测序数据读长裁剪而来。
我们基于 NEX-t Panel 设计策略,通过内部打分算法比对与公开数据库比对,将可捕获的耐药和毒力基因序列构建成内部数据库。数据库中的每种耐药和毒力基因均已进行注释分类和人工校对。此外,数据库也根据公开数据库和文献报道将耐药基因进行等级划分,为后续分析和报告提供参考。
03 结果
3.1 mNGS 和 tNGS 的数据量对比
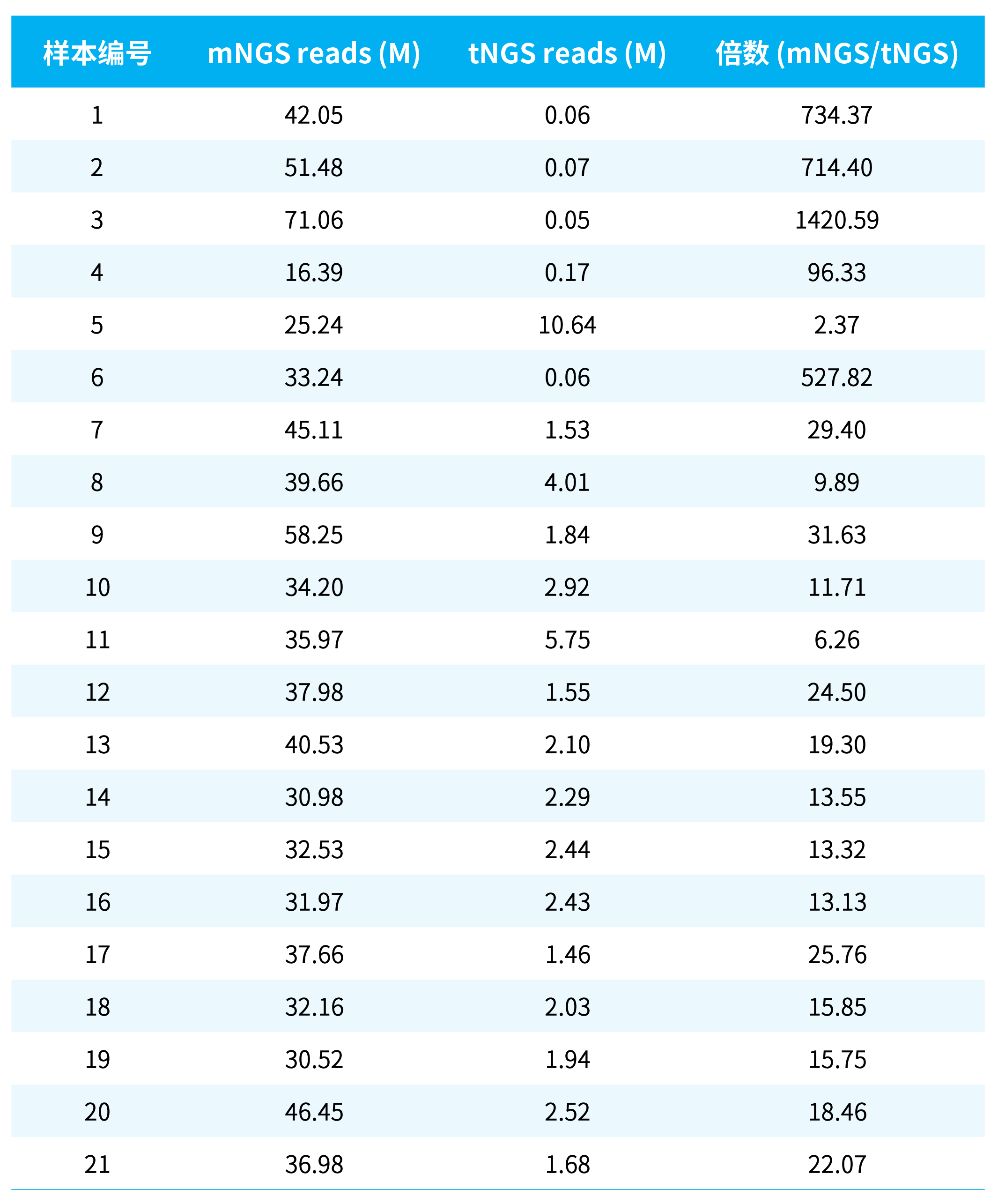
针对常见的人源细胞背景下 (105 cells/mL) 的临床标本,采用 mNGS 进行病原微生物鉴定的推荐测序量为 20 M reads。如果同时考虑检测耐药基因,则需要的数据量应增加 10~100 倍。这 21 例样本的 mNGS 结果中,mNGS 平均测序量达到了 35 M reads,为推荐值的 1~2 倍,满足病原微生物鉴定要求,但不完全足够支撑耐药和毒力基因的分析。
而 tNGS 的平均测序量仅为 2 M
reads,在一些低拷贝数样本中,甚至低至 0.05 M reads (表 1.)。tNGS 的优势在于靶向富集捕获,其宿主占比要低于 mNGS 的宿主占比 (5 号样本除外,因其来源为非结核分支杆菌落,几乎无宿主占比)。数据利用率的提升,意味着 2 M reads 也足以满足后续分析要求。
表 1. mNGS 和 tNGS 的病原数据量和宿主占比
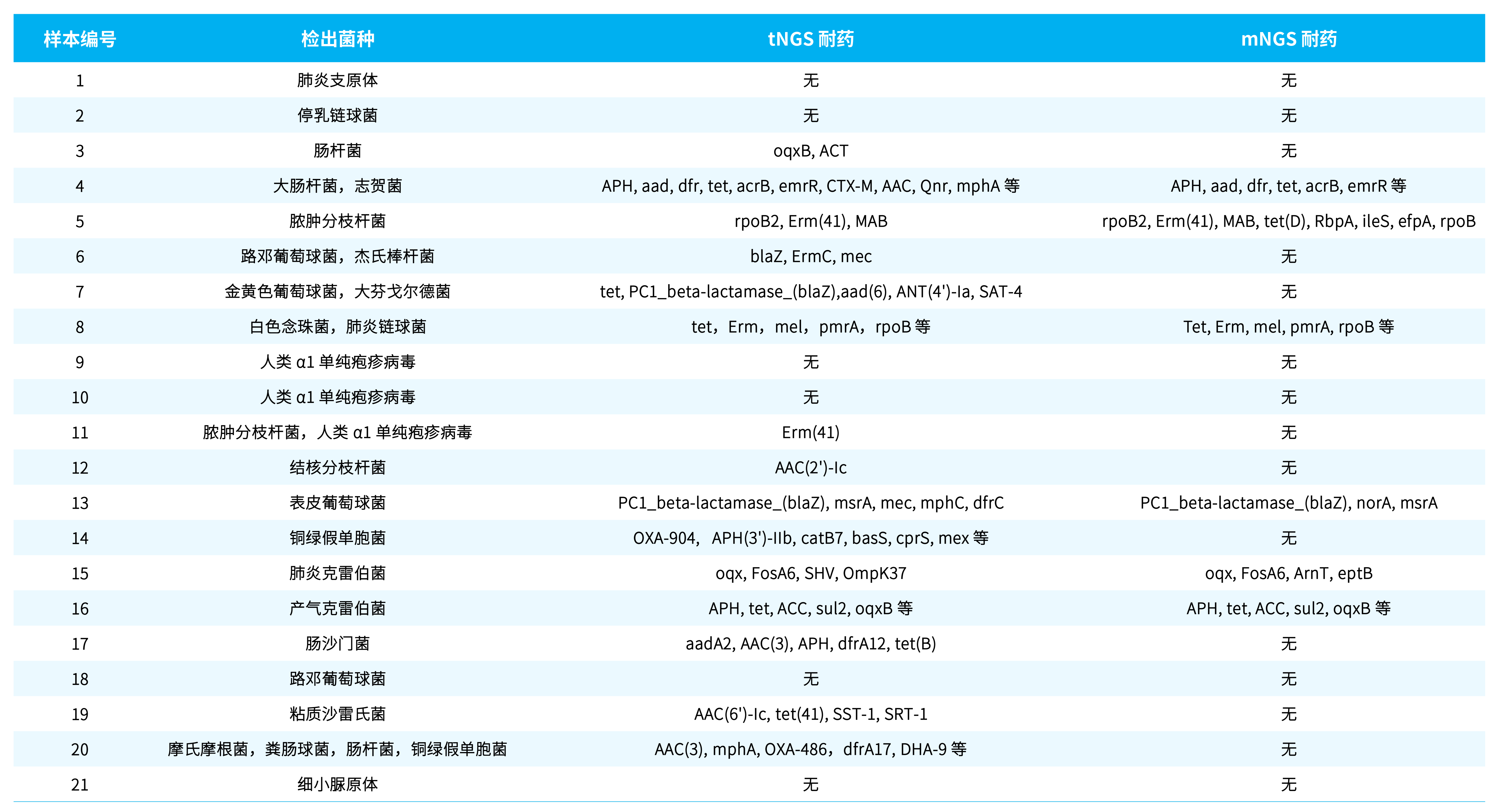
3.2 耐药基因分析示例
在对 21 例样本耐药基因检测后,再结合各个样本检出的菌种类型、检出耐药基因的支持 read 数及耐药基因序列的覆盖率进行最终鉴定。当检出的耐药基因属于检出菌种且有较多 read 支持时,才认为其是可信耐药基因。判断标准为:tNGS 检出 unique reads 数 > 20,mNGS 检出 reads 需 >
1。tNGS 检测结果中有 15 例样本具有可信的耐药基因,而 mNGS 检出有耐药基因的样本中仅 6 例可信 (表 2.)。
表 2. mNGS 和 tNGS 的耐药基因检出对比
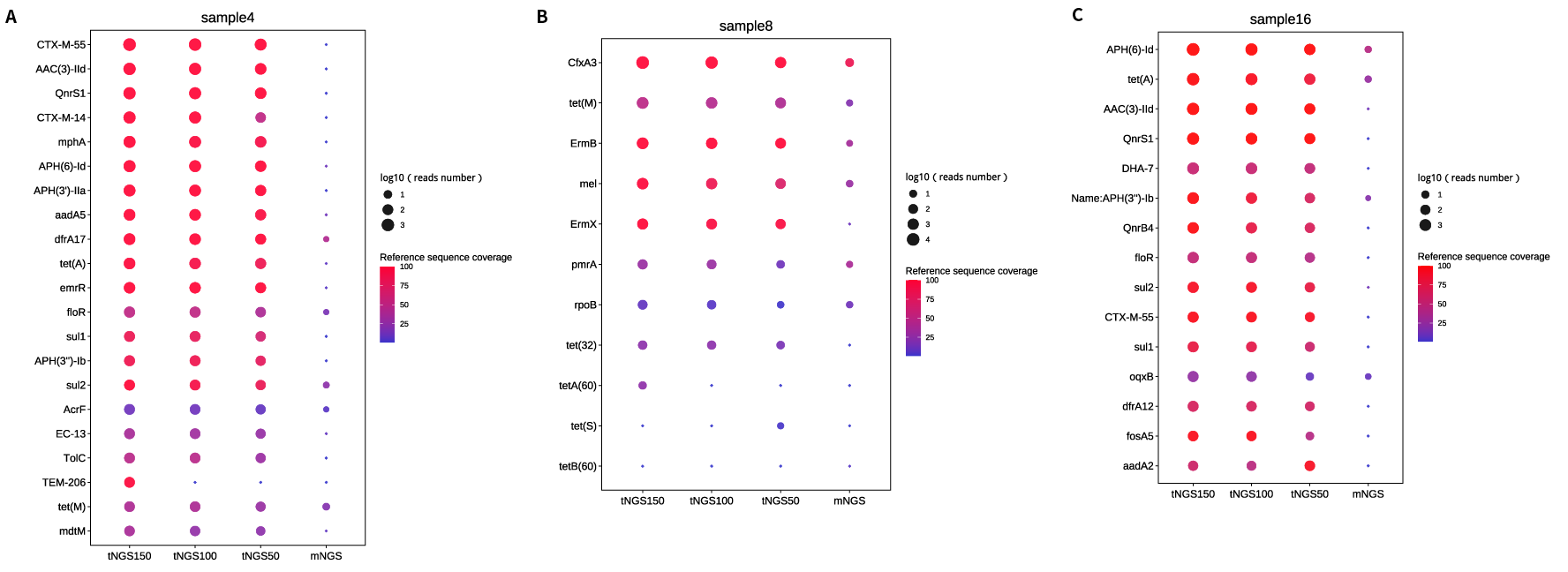
由于 tNGS 对耐药基因检测的富集作用,使得一些 mNGS 中无法检测到的或者可信度不高的耐药基因得以检出,如在 3、6、7、11、12、14、17、19、20 号样本中的 CTX-M、tet 等基因。4 号样本病原体检出为大肠杆菌和志贺菌,在耐药基因的检测中 tNGS 检出了 CTX-M 基因且丰度为最高,但 mNGS 则未检出 (图 1.A)。
而 16 号样本的 tNGS 测试检出的耐药基因高丰度前三依次为 APH、tet 和 AAC,此三类耐药基因均在产气克雷伯菌中报道过。其中 APH 和 AAC 的耐药机制主要是通过产氨基糖苷类修饰酶 (aminoglycoside modifying enzymes, AME) 或通过核糖体靶位修饰介导,对青霉素和糖肽类与氨基糖苷类联用呈现耐药。而 Tet 家族在许多不同类别的细菌中都有表征,可以在可转座元素上水平移动,授予高水平的四环素耐药性,其耐药原理为催化四环素氧化达到失活的效果。本次研究的 16 号样本可以明显看出 tNGS 对于低丰度耐药基因的富集效果显著高于 mNGS (图 1.C)。
由于 tNGS 对耐药基因的富集是基于探针捕获,当未针对某耐药基因设计时,可能出现 mNGS 能够检出的耐药基因,tNGS 反而无 read 支持情形,例如示例样本 5、13、15 中的 RbpA, ileS 等基因。尤其是 5 号样本为脓肿分支杆菌菌落样本,由于本 tNGS 检测试剂盒并未针对结核分支杆菌复合群和非结核分支杆菌的全部耐药和毒力基因设计,故相对于 mNGS 检出结果较少。
3.3 毒力基因分析示例
在对 21 例样本进行毒力基因检测后,再结合各个样本检出的菌种类型及检出耐药基因的支持 read 数进行毒力基因鉴定的结果如表 3. 所示。
表 3. mNGS 和 tNGS 的毒力基因检出对比
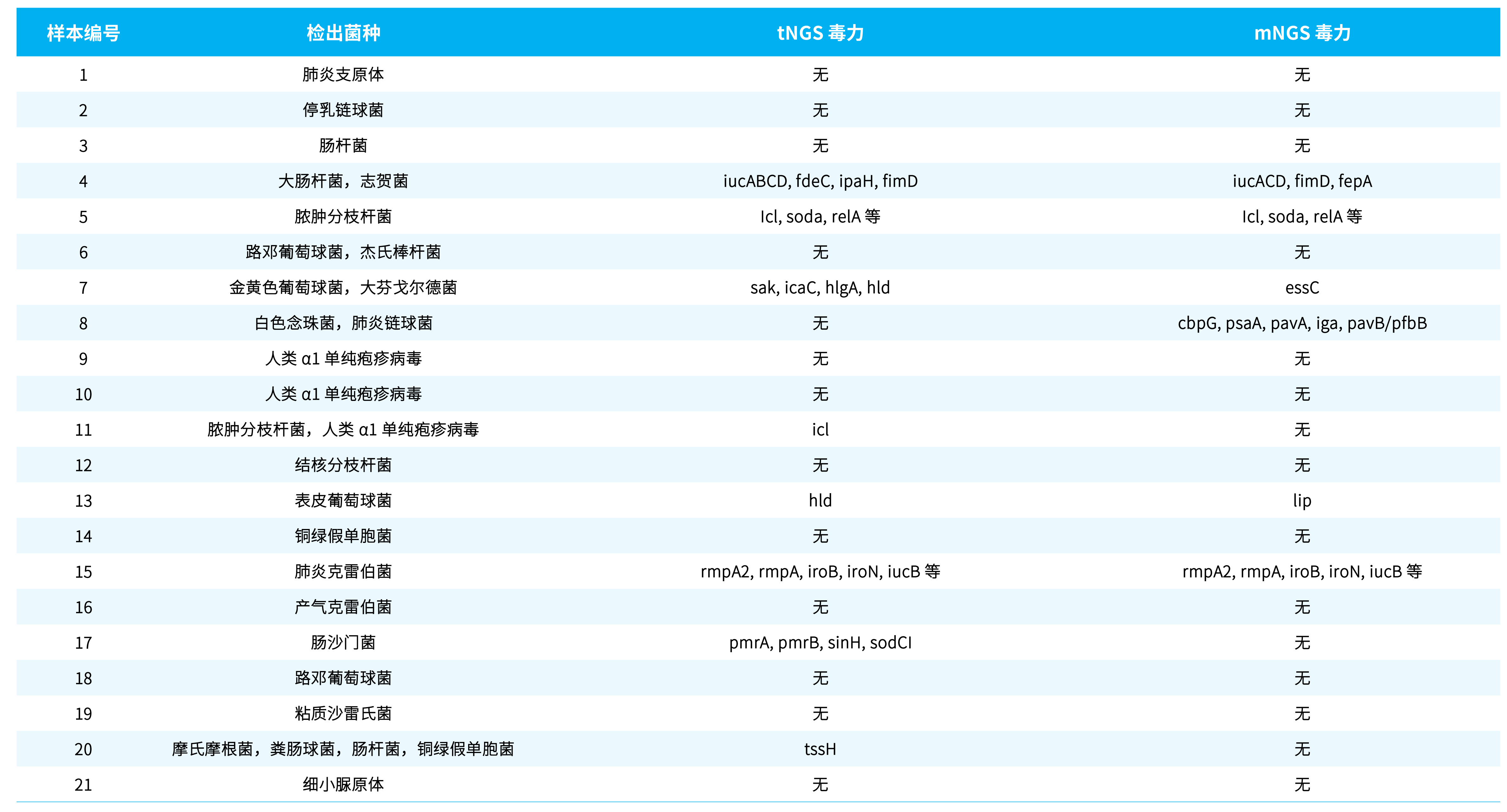
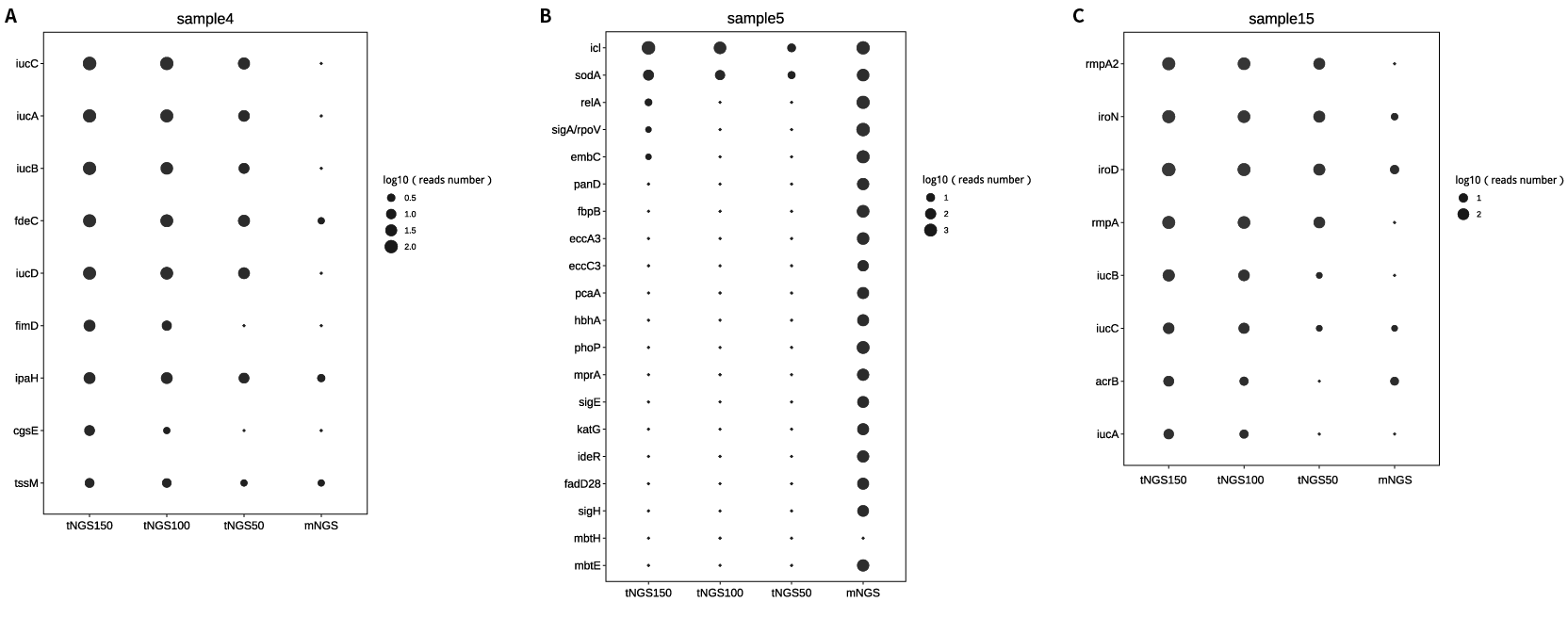
4 号样本中毒力基因检出了跟大肠杆菌和志贺菌相关的荚膜多糖调节毒力基因家族 iuc (图 2.A)。荚膜多糖最早于 1917 年由 Avery 和 Dochez 在研究肺炎链球菌 (Streptococcus pneumoniae) 时发现,后被证明这种物质是存在于微生物荚膜中的碳水化合物。荚膜多糖作为病原微生物最外层的保护成分,可有效保护菌体免受或少受多种杀菌、抑菌物质的损伤,有助于病原体在宿主内定植和为入侵宿主争取时间。荚膜多糖既可作为毒力因子逃避宿主免疫监视促进致病性感染。
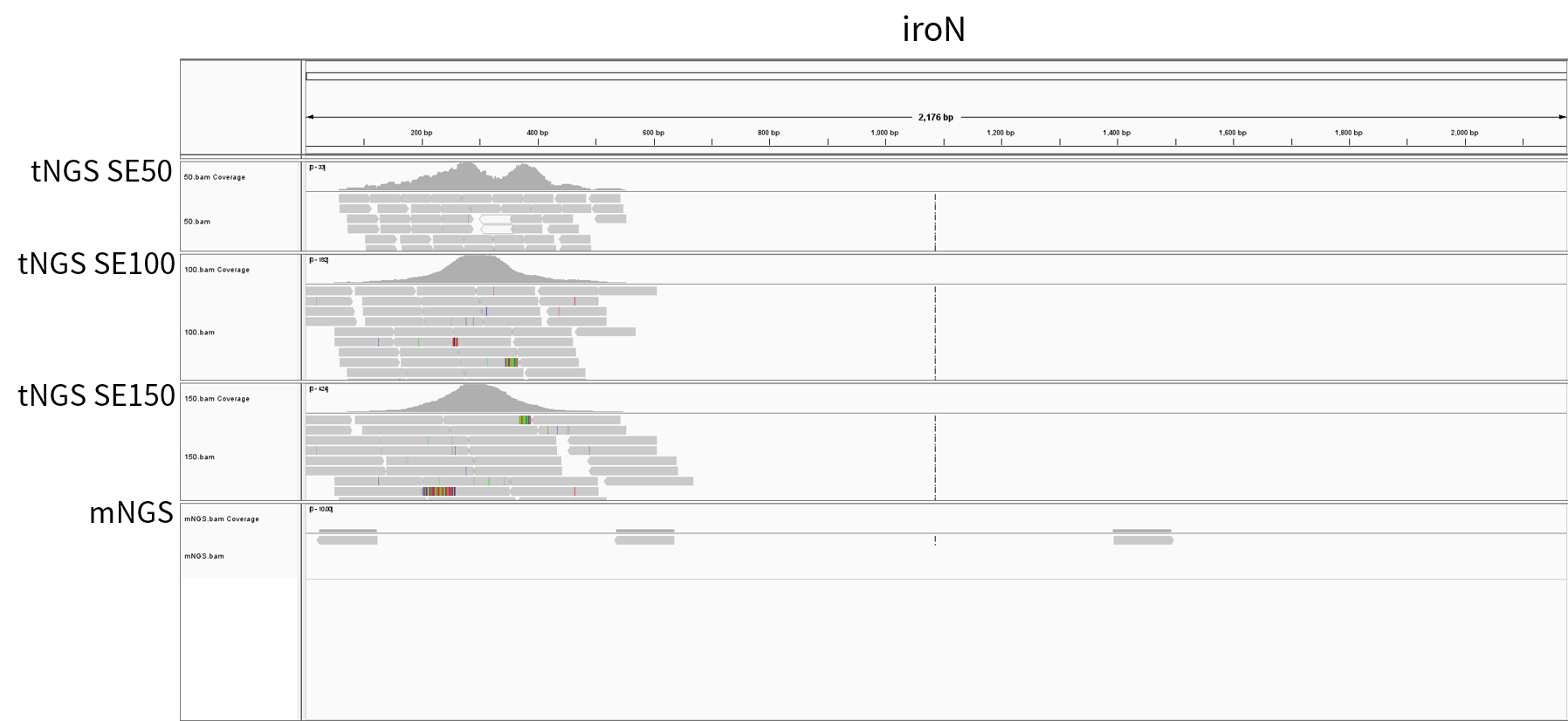
15 号样本病原体检出为肺炎克雷伯菌,其毒力基因检出为 rmpA2,rmpA,iroB,iroN,iucB 等常见的高毒力肺炎克雷伯菌 (hyper virulent Klebsiella pneumoniae, hvKp) 的荚膜多糖毒力因子 (图 2.C)。促成 hvKp 毒力表型的关键特征之一是荚膜多糖表达产量的增加,这一表型部分由 rmpA 和/或 rmpA2 所调控。通过以上案例可以看出 tNGS 对耐药基因检测的富集作用同样适用于毒力基因检测,使得一些 mNGS 中无法检测到的或者可信度不高的毒力基因得以检出,如在 4、7、11、13、15、17、20 号样本中的 iucB、ipaH、fimD 等基因。
但是在某些病原体样本中不存在针对某毒力基因设计的探针时,tNGS 很难为该毒力基因提供可信的 read 支持,此时 mNGS 检测的全面性优势得以展现,例如样本 5,8 和 13 (图 2.B)。
3.4 tNGS 杂交捕获的富集效果
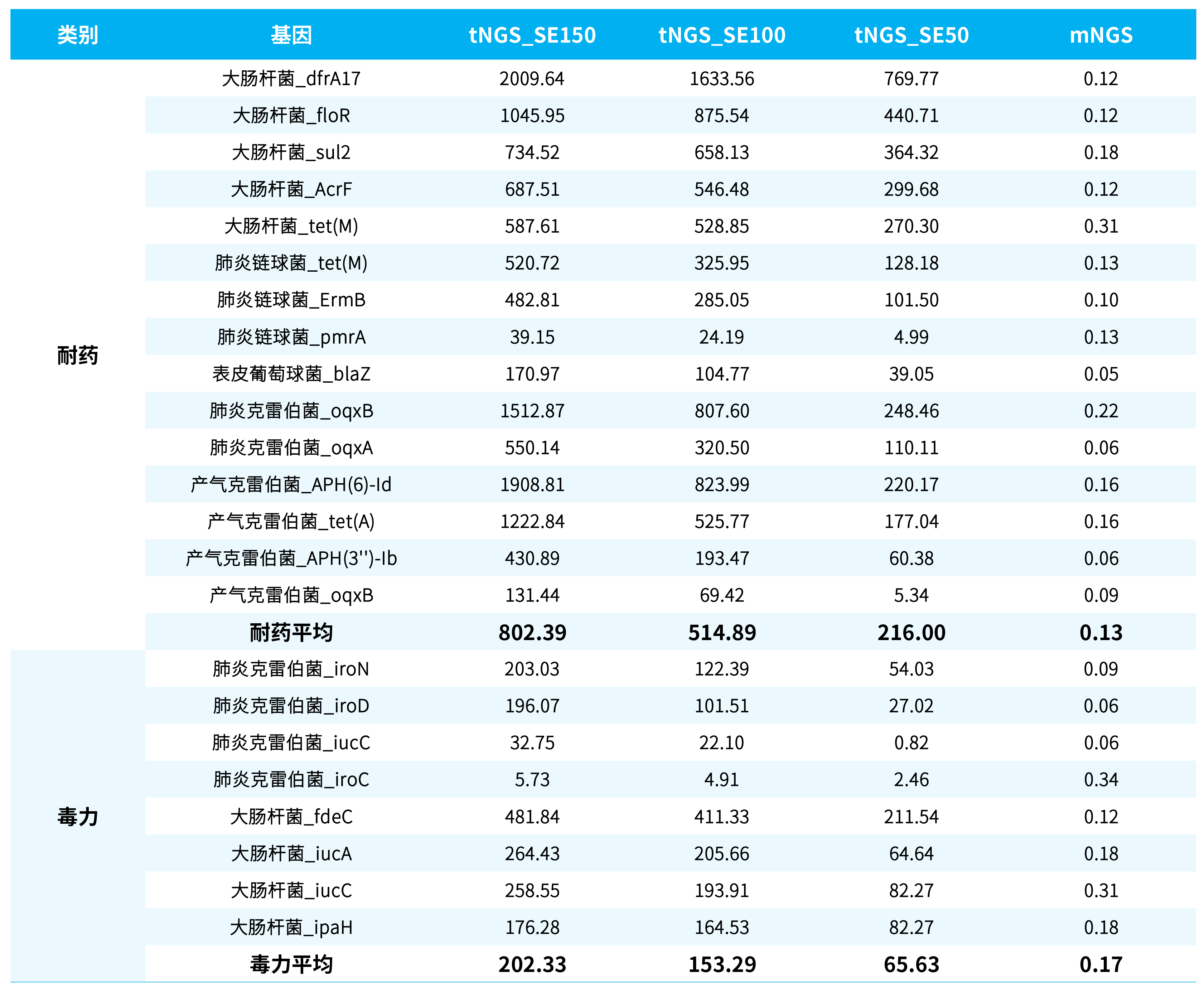
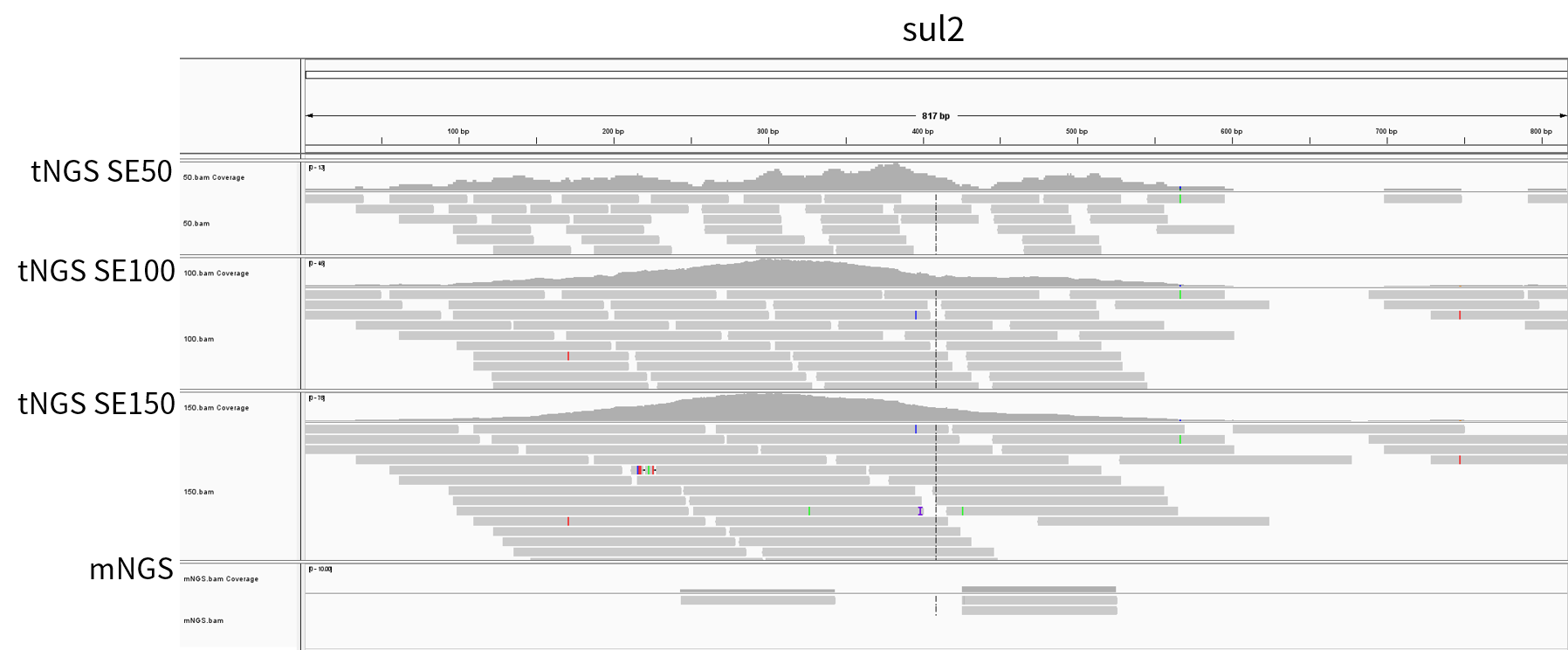
本次示例中选取在 tNGS_SE150、tNGS_SE100、tNGS_SE50 及 mNGS 分析时均可信的耐药与毒力基因,以其支持的 read 数除以该样本的总 read 数 (M),可得到均一化 RPM 值 (表 4.)。不难看出,在同等测序量的情况下,tNGS 检测出的耐药及毒力基因的 read 数量远远大于 mNGS,平均可富集 400-6000 倍。与此同时,我们可以发现随着测序读长长度提高,富集的效果也更显著。
表 4. tNGS 对耐药和毒力基因的富集程度
04 讨论
抵抗感染的关键在于及时有效的药物治疗。传统的抗生素敏感性试验检测方法通常是对培养分离的病原体进行的。该方法不仅耗费较长的时间,而且非常容易忽视某些无法培养的病原体。
mNGS 平台能够快速、全面识别罕见、新颖、难以检测和共感染的病原体,但是不适用于耐药和毒力基因检测。如果对 mNGS 报告的病原体全覆盖用药,则是抗生素药物的另一种滥用。tNGS 在检测耐药和毒力基因上有着天然强大的富集优势。尤其是在病原体负荷较低的情况下,能有效避免在 mNGS 中遗漏的低拷贝数耐药、毒力基因序列。
在本文的示例中,NEX-t Panel v1.0 作为一种更经济、更便捷的解决方案,既能全面有效的进行病原鉴定,也适用于耐药和毒力基因检测。这有助于我们加强对病原体感染的了解和综合判断,避免盲目依据 mNGS、多重 PCR 检测、培养组学等单一手段开展治疗导致的抗生素滥用。
参考文献
[1] 刁振丽, 李金明. 宏基因组高通量测序技术的临床应用: 现状, 挑战与前景[J]. 协和医学杂志,
2023, 14(5): 905-910.
[2] Abram T J, Cherukury H, Ou C Y, et al.
Rapid bacterial detection and antibiotic susceptibility testing in whole blood
using one-step, high throughput blood digital PCR[J]. Lab on a Chip, 2020,
20(3): 477-489.
[3] Blauwkamp T A, Thair S, Rosen M J, et
al. Analytical and clinical validation of a microbial cell-free DNA sequencing
test for infectious disease[J]. Nature microbiology, 2019, 4(4): 663-674.
[4] Campion M, Scully G. Antibiotic use in
the intensive care unit: optimization and de-escalation[J]. Journal of
intensive care medicine, 2018, 33(12): 647-655.







