不用“折腾”样本,DNA 甲基化全场景解决方案,一次搞定 10 大高发癌种!
01 应用背景
恶性肿瘤已成为全球重大公共卫生挑战,而筛查和早诊早治可以有效降低恶性肿瘤的死亡率,通过“早筛查、早发现、早干预”等技术手段可显著提升患者的治愈率和生存率。通常,肿瘤细胞在增殖或凋亡时会释放携带特异性突变或甲基化标记的 DNA 片段 (ctDNA) 进入血液,如同癌症的“分子指纹图谱”。与传统的肿瘤标志物相比,DNA 甲基化标志物具有更早期、更无创、更精准等特点,适用于肿瘤筛查、辅助及伴随诊断、微小残留病灶 (MRD) 监测与复发预警,以及预后评估等多重场景[1-5]。已有研究表明,结合 ctDNA 甲基化与突变双标志物进行纵向和 MRD 监测分析,可将 MRD 检测的相对灵敏度提高 25% ~ 36%[6]。
然而,传统的 DNA 甲基化检测通常依赖于序列转化,主要包括亚硫酸氢盐和酶法转化:前者虽然快速高效,但易导致 DNA 降解和断裂,仅适用于高起始量样本;后者虽然相对温和,但操作繁琐耗时长且转化效率不稳定。因此,纳昂达推出了超灵敏度甲基化与突变共检测全流程解决方案 (μCaler® DNA Full Screen System),无需序列转化,仅凭有限样本即可实现超高灵敏共检,在简化流程的同时最大限度保留原始模板信息,大幅提升覆盖深度;尤其是在低丰度信号检测场景下,μCaler® DNA Full Screen System 有望成为恶性肿瘤早期筛查与术后 MRD 复发监测的重要工具之一。
为了充分发挥该系统优势,纳昂达即将推出 μCaler® FS EMS+ Panel v1.0,全面覆盖 10 大高发癌种的关键 CpG 位点,精准检测待测样本中目标癌种候选基因的甲基化状态,为 DNA 甲基化标志物在肿瘤精准医疗领域中的应用提供有力工具,加快推动科研成果向临床应用转化。
02 方案介绍
2.1 产品简介
μCaler® FS EMS+ Panel v1.0 精选了经 NMPA 和 FDA 批准的位点,同时囊括了文献和专利报道中具有重要意义的位点,共计包含 1,783 个 CpG 位点。覆盖 10 大高发癌种,包括肺癌、乳腺癌、结直肠癌、前列腺癌、胃癌、肝癌、宫颈癌、膀胱癌、食管癌、卵巢癌,涉及 163 个与致癌和肿瘤抑制相关的甲基化候选基因。探针设计涵盖基因组约 0.1 Mb 区域,覆盖 9,680 个位点,为全面且精准的甲基化早筛和 MRD 复发监测提供强有力的技术方案支持。
表 1. μCaler® FS EMS+ Panel v1.0 目标癌种及甲基化候选基因。
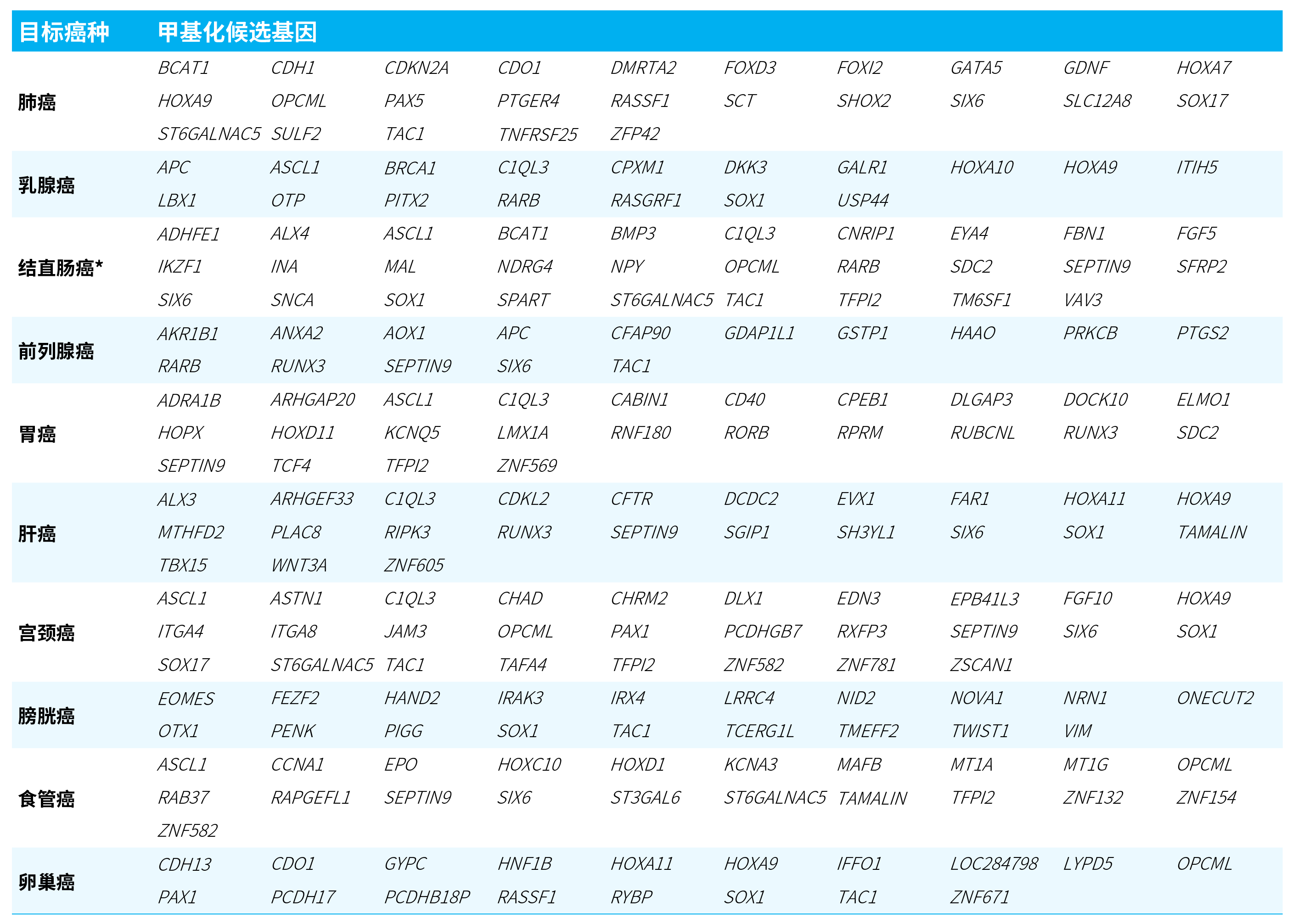
*此外还覆盖了表中未列出的基因间区 (Intergenic,含 12 个 CpG 位点)。
2.2 特色亮点
样本兼容:广泛适用于 gDNA、cfDNA 及不同等级的 FFPE DNA 样本。
多癌检测:一次性覆盖全球 10 大高发癌种具有重要意义的 CpG 位点。
灵活定制:可针对单癌种或多癌种,定制不同规模 CpG 位点和或基因突变的探针包。
精准定量:支持不同甲基化状态 (0% ~ 100%) 样本实现准确且稳定的甲基化水平定量。
高效捕获:无需序列转化,充分保留原始序列丰富度,数倍提高有效覆盖深度。
超高灵敏:支持搭配双端唯一分子标签接头实现对低至极低丰度信号的超高灵敏度检测。
2.3 应用拓展
• 双场景覆盖,全周期守护
I. 早期筛查与风险预警
针对目标癌种,通过队列样本 (临床患者与健康对照) 构建早筛模型,并结合长期随访样本库,对模型进行风险评分,精准评估甲基化风险对“癌前病变”到“早期癌症”转换的预警能力,提前锁定风险人群。
II. 复发监测与疗效评估
聚焦根治性手术切除和或放化疗后患者,定期检测血液样本中 ctDNA 甲基化状态,精准识别 MRD 阳性信号,及时评估肿瘤复发或转移风险,辅助疗效监测与个性化治疗方案调整。
• 即用型 or 定制化,灵活适配个性化需求
I.无候选 Biomarkers
直接采用 μCaler® FS EMS+ Panel v1.0,依托 Panel 中预设的关键基因快速启动标志物筛选,有效降低产品开发成本与周期。
II. 有候选 Biomarkers
支持个性化灵活定制探针 (独立或混合使用),满足特定癌种研究需求,灵活拓展应用边界。
• 多组学联合检测
支持定制特定驱动基因突变与甲基化双标志物的联检方案,显著提升综合检测性能,满足个性化科研与临床探索需求。
03 产品表现
3.1 稳定检测甲基化信号
4 例临床确诊的患者肿瘤组织样本采用 μCaler® DNA Full Screen System 全流程解决方案联合 μCaler® FS EMS+ Panel v1.0 进行甲基化水平检测的稳定性评估,每例样本进行两次重复检测,对 μCaler® FS EMS+ Panel v1.0 中特定癌种包含的 CpG 位点的甲基化水平进行相关性分析。结果显示,4 例临床样本相关性分析 R2 值范围为 0.9279 ~ 0.9707 (图 1.),平均 R2 值为 0.9458。由此可见,μCaler® FS EMS+ Panel v1.0 针对同一 CpG 位点的甲基化水平重复检测时能够保持高稳定性。
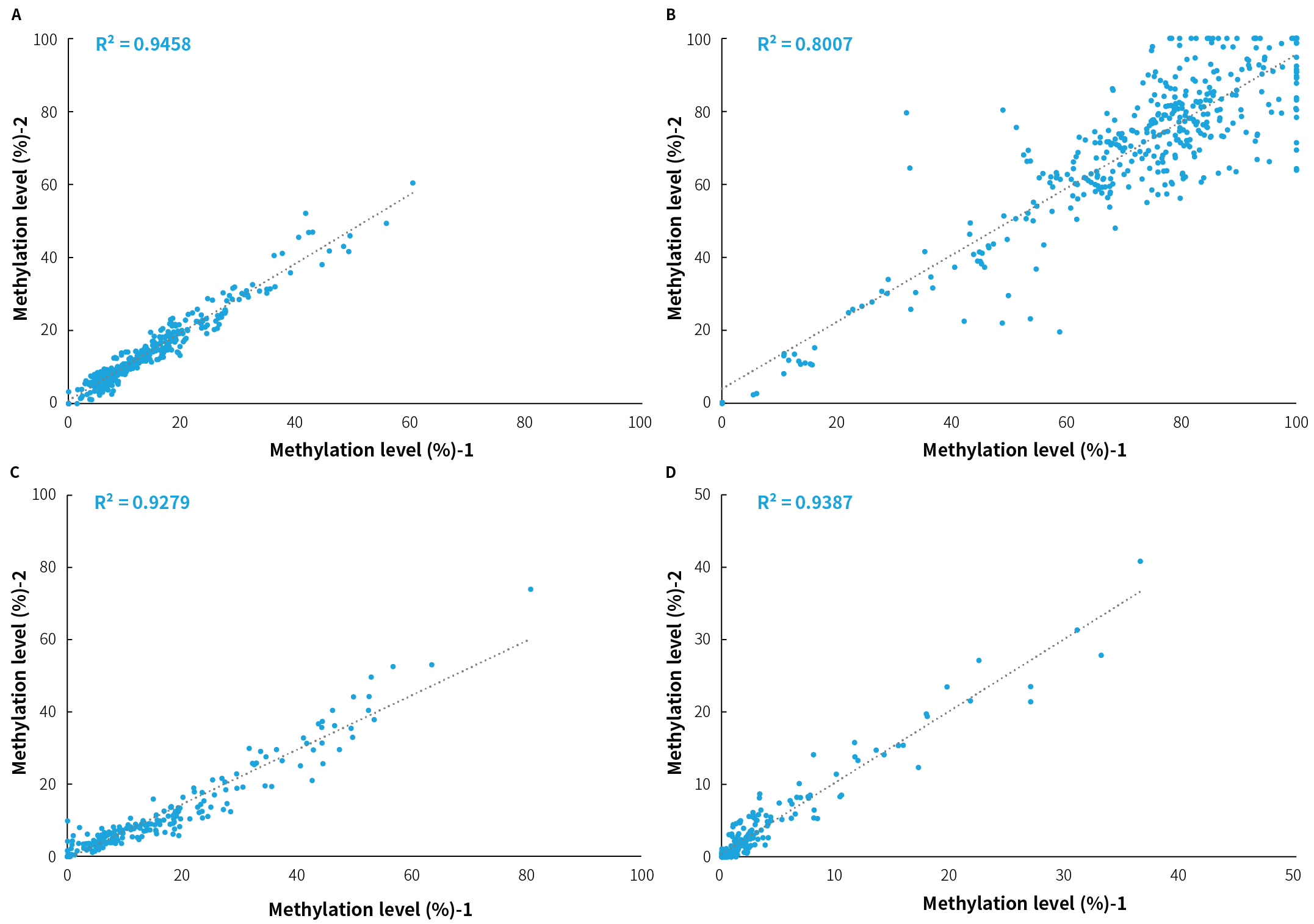
图 1. μCaler® FS EMS+ Panel v1.0 对同一样本两次重复之间检出甲基化水平的相关性分析。A-D. 4 例独立样本两次重复检测的甲基化水平相关性。随机选取 4 例临床肿瘤组织样本 (A & B 为结直肠癌,C & D 为膀胱癌) 利用 μCaler® DNA Full Screen System 全流程解决方案和 μCaler® FS EMS+ Panel v1.0 完成杂交捕获。测序模式为 NovaSeq 6000,PE150。随机选取 1 M reads pair 进行数据分析。
注:样本起始投入量为 20 ng。
3.2 有效区分肿瘤和癌旁组织
3.2.1 结直肠癌肿瘤-癌旁配对样本
使用 7 例临床确诊的结直肠癌患者的肿瘤-癌旁配对组织及健康对照样本 (Control) 对 μCaler® FS EMS+ Panel v1.0 中结直肠癌候选标志物的检测性能进行评估。结果显示,肿瘤组织的甲基化水平明显高于癌旁组织和健康对照 (图 2. A);综合结直肠癌全部候选基因的甲基化谱,该 Panel 能够有效区分肿瘤组织与癌旁组织及健康对照 (图 2. B)。然而,部分候选标志物 (如 SDC2) 在部分患者癌症组织中呈现低甲基化水平 (图 2. B);由此可见,仅通过单基因的甲基化水平检测难以适用所有肿瘤患者,因而多基因联合甲基化分析对检测敏感性的提升具有重要意义。
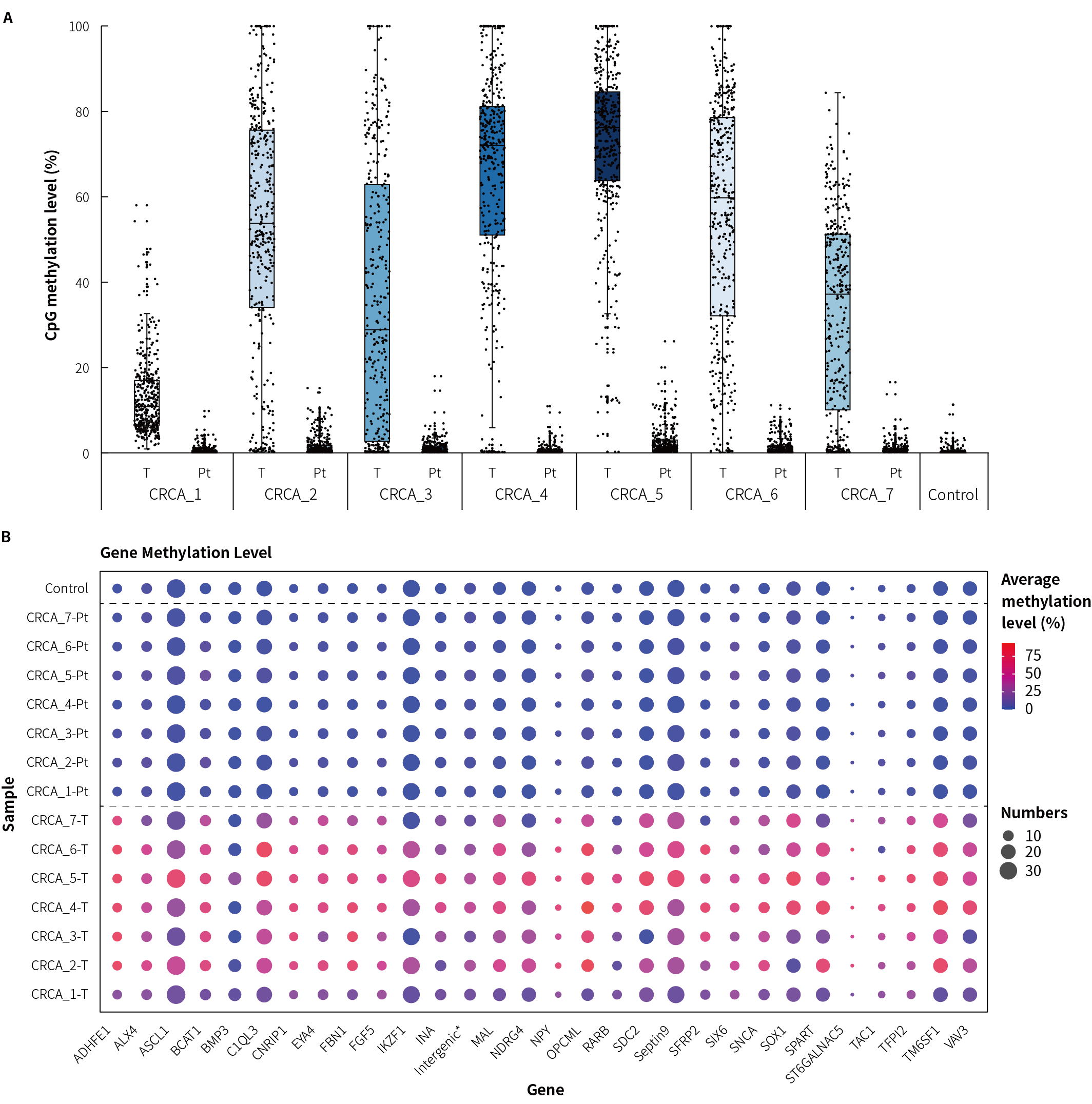
图 2. μCaler® FS EMS+ Panel v1.0 应用于临床结直肠癌及其癌旁组织时的甲基化水平检出情况。A. 结直肠癌配对样本 CpG 甲基化水平;B. 结直肠癌候选 Biomarkers 在临床样本中的 CpG 甲基化水平。
注:CRCA: Colorectal Cancer;Pt: Peritumoral tissue。Control 为人类基因组 DNA 标准品 (Promega,G1471)。样本起始投入量为 20 ng。
3.2.2 肺癌肿瘤样本
使用 5 例临床确诊的肺癌患者的肿瘤组织和健康对照样本对 μCaler® FS EMS+ Panel v1.0 中肺癌候选标志物的检测性能进行评估。结果显示,5 例肺癌肿瘤组织样本的平均甲基化水平分别为 66.09%,21.83%,11.10%,22.96% 和 10.87%,而健康对照样本的平均甲基化水平仅为 0.56% (图 3. A);综合肺癌全部候选基因的甲基化谱,该 Panel 在肺癌肿瘤组织和健康对照样本中展现出了良好的区分能力 (图 3. B)。
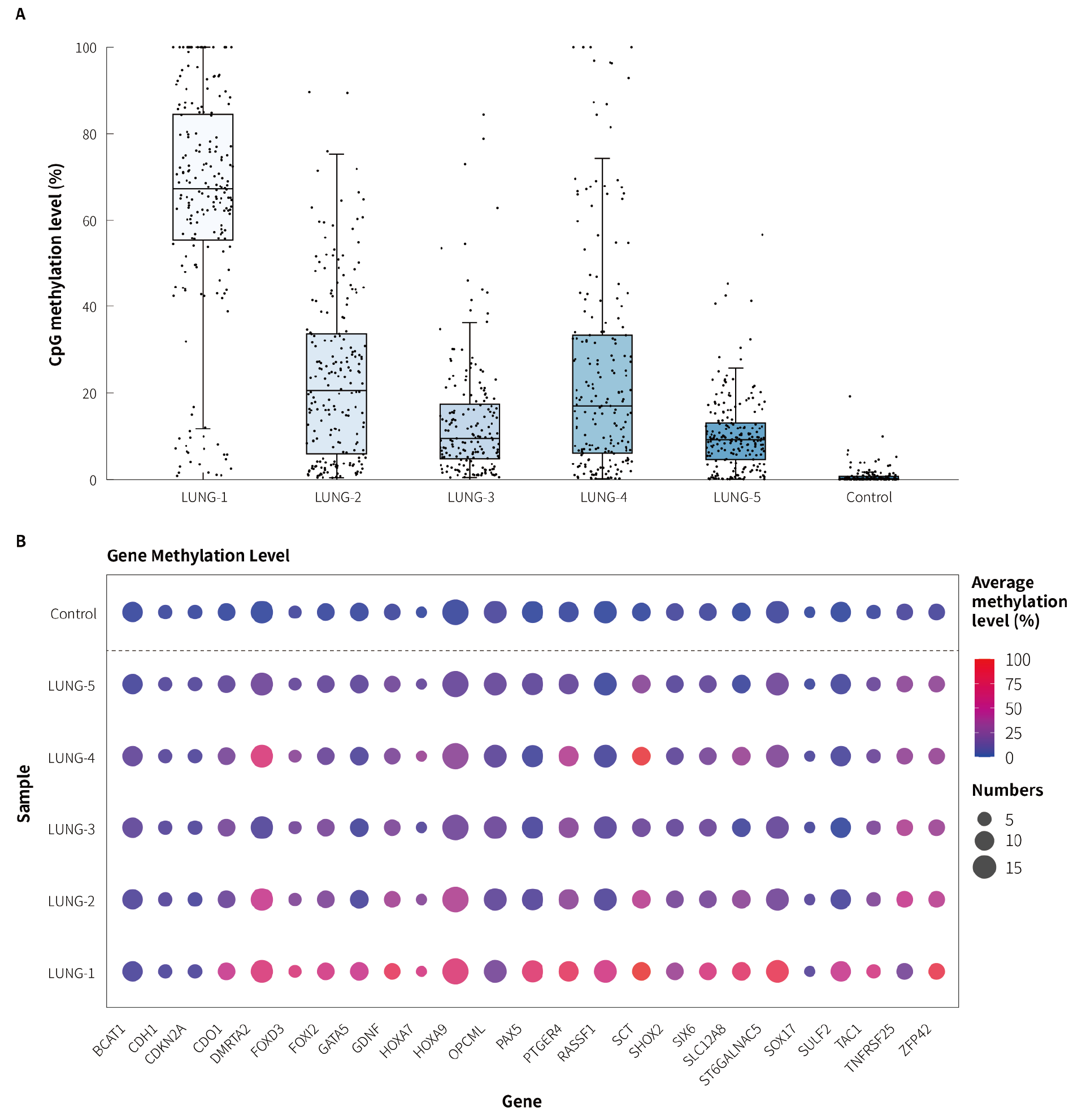
图 3. μCaler® FS EMS+ Panel v1.0 应用于临床肺癌组织样本时的甲基化水平检出情况。A. 肺癌样本 CpG 甲基化水平;B. 肺癌候选 Biomarkers 在临床样本中的 CpG 甲基化水平。
注:LUNG: Lung Cancer。样本起始投入量为 20 ng。
04 应用示例
情景一
前期未进行大规模 DNA 甲基化标志物筛选,是否可直接从 μCaler® FS EMS+ Panel v1.0 中预设的肺癌标志物中挑选进而定制探针,并基于定制 Panel 评估其在肺癌筛查中的应用潜力?
测试结果
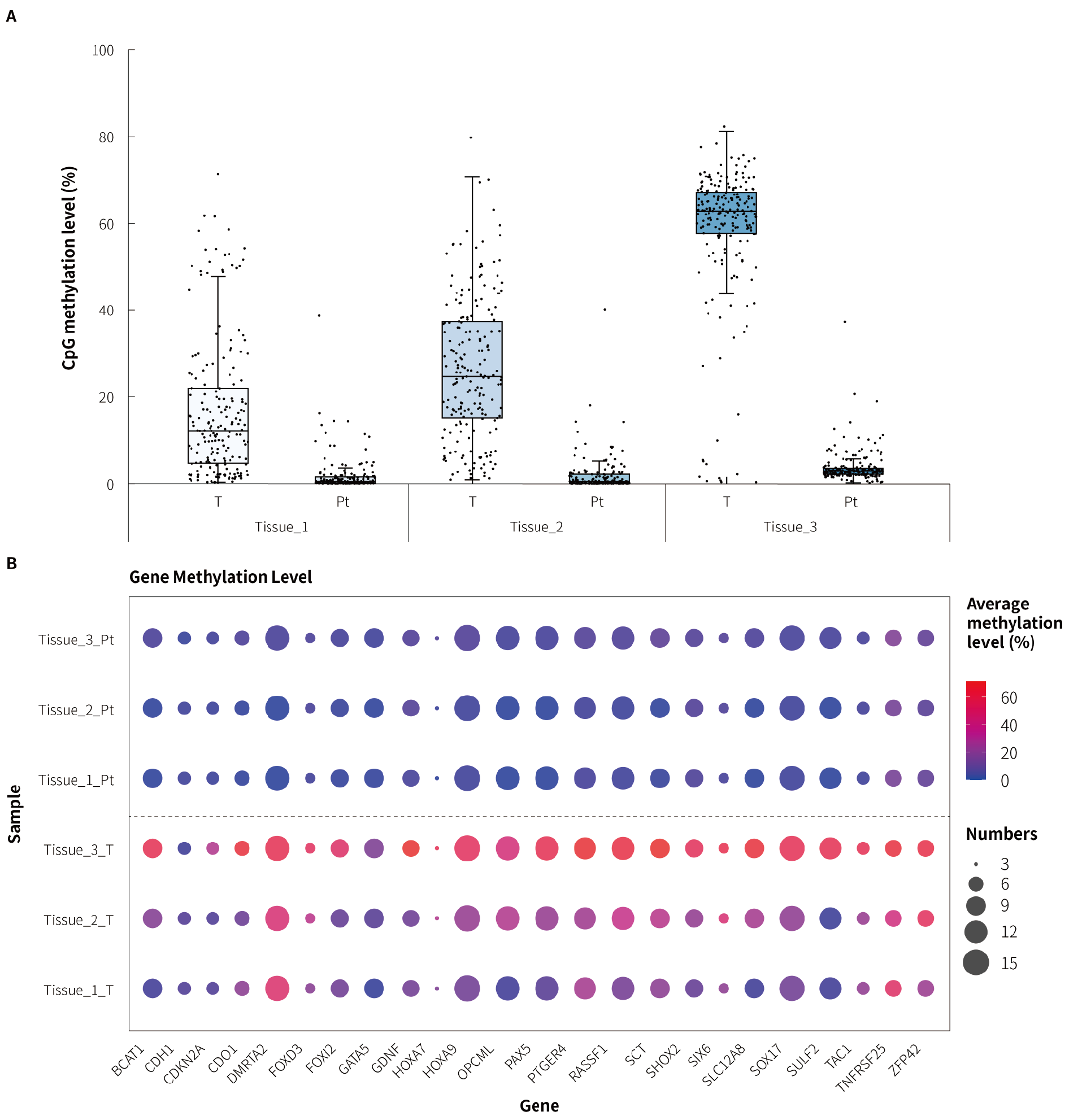
图 4. μCaler® DNA Full Screen System 全流程解决方案应用于临床肺癌患者的捕获表现。A. 肺癌配对样本 CpG 甲基化水平;B. 肺癌候选 Biomarkers 在临床样本中的 CpG 甲基化水平。参照 μCaler® DNA Full Screen System 全流程解决方案使用说明书,以 μCaler® FS 个性化定制 Panel (DNA 甲基化:含 24 个候选 Biomarkers,共计 208 个 CpG 位点) 完成杂交捕获,测序模式为 NovaSeq 6000,PE150。随机选取 1 M reads pair 进行数据分析。
注:T 为肺癌患者肿瘤组织,Pt 为肺癌患者癌旁组织。起始投入量为 50 ng。
使用 3 例临床确诊的肺癌患者的肿瘤-癌旁组织配对样本对 μCaler® FS 个性化定制 Panel 中肺癌候选标志物的检测性能进行评估。结果显示,肺癌肿瘤组织的甲基化水平显著高于癌旁组织 (图 4. A);综合肺癌全部候选基因的甲基化谱,该定制 Panel 能够有效区分肿瘤组织与癌旁组织 (图 4. B)。由此可见,μCaler® FS EMS+ Panel v1.0 中预设的肺癌标志物在肺癌筛查中具有一定的应用潜力,能够为肺癌早筛生物标志物的发现与早筛模型的构建提供有力支持。
应用拓展小结一
在缺乏自有候选 Biomarker 时,可直接从 μCaler® FS EMS+ Panel v1.0 中自由挑选单癌种或多癌种的预设标志物,从而快速定制个性化 Panel,并对临床队列样本进行甲基化检测以构建目标癌种的早筛模型。随后,通过纵向样本库对模型进行打分,评估甲基化风险评分对“癌前病变”到“早期癌症”转换的窗口期,并设定风险分级和预警阈值,最终实现对临床样本的提前预警。
DNA 甲基化异常是驱动癌症发生和发展的重要表观遗传修饰之一,通常发生在癌症病程的早期阶段。因此,DNA 甲基化可以作为肿瘤等早期诊断的生物标志物和预后评估指标,对肿瘤的筛查和风险评估、早期诊断、分期分型、预后判断及治疗监测都具有重要的意义。
情景二
前期已筛选出肺癌相关的关键基因突变位点,是否可联合从 μCaler® FS EMS+ Panel v1.0 中挑选的肺癌标志物进而定制合成单管探针,并基于定制 Panel 评估 DNA 甲基化与突变双标志物在肺癌 MRD 复发监测中的应用潜力?
测试结果
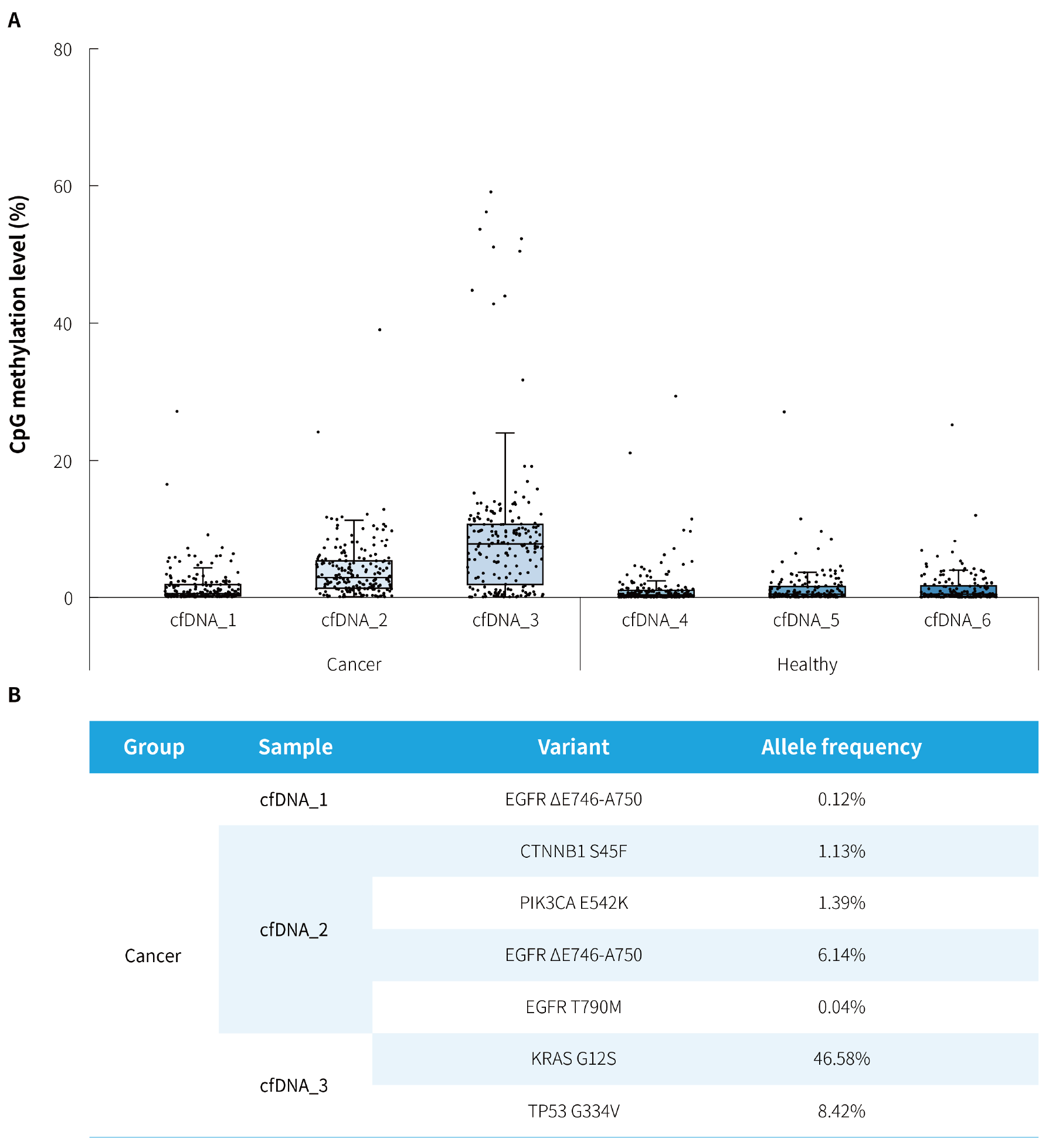
图 5. μCaler® DNA Full Screen System 全流程解决方案应用于临床肺癌患者 MRD 复发监测的捕获表现。A. 肺癌候选 Biomarkers 在临床术后复发患者及健康人 cfDNA 样本中的 CpG 甲基化水平;B. 肺癌候选 Biomarkers 在临床术后复发患者 cfDNA 样本中的突变频率。参照 μCaler® DNA Full Screen System 全流程解决方案使用说明书,以 μCaler® FS 个性化定制 Panel (DNA 甲基化:含 24 个候选 Biomarkers,共计 208 个 CpG 位点;DNA 突变:5 个候选 Biomarkers) 完成杂交捕获,测序模式为 NovaSeq 6000,PE150。以 fgbio 联合 Vardict 进行变异分析,分析过滤标准为双链一致性序列 (Duplex Consensus Sequences, DCS211) (预文库含双端唯一分子标签,UMIs)。
注:Cancer 为肺癌复发患者血浆 cfDNA,Healthy 为健康人群血浆 cfDNA。起始投入量为 20 ng。
使用 3 例临床肺癌术后复发患者和 3 例健康人群的血浆 cfDNA 样本对 μCaler® FS 个性化定制 Panel 在 MRD 复发监测中的检测性能进行评估。结果显示,术后复发患者的平均甲基化水平分别为 1.4%,3.8% 和 8.7%,且随着复发进程呈现梯度升高;结合健康人群对照,能够区分出 MRD 阳性状态 (图 5. A);同时,在 3 例术后复发患者的血浆 cfDNA 样本中均检测出相应的 MRD 特异性突变 (图 5. B),与 DNA 甲基化标志物检测结果形成有力互证。
应用拓展小结二
在已筛选突变标志物的基础上,可直接从 μCaler® FS EMS+ Panel v1.0 中自由挑选预设的甲基化标志物,从而快速定制合成单管探针,并结合 μCaler® DNA Full Screen System 全流程解决方案,以术后样本建立“无病状态”甲基化与突变谱。同时,基于基线分布特征设定预警阈值,利用定制 Panel 定期监测随访 cfDNA 样本中的甲基化水平和突变变化,以判定 MRD 阳性或复发风险,并在后续治疗中持续监控,以评估治疗效果并指导个体化治疗。
相较于仅依赖突变标志物检测,甲基化标志物无需依赖原发肿瘤突变谱,其不受突变频率和突变位点数量的限制,可显著提升 MRD 监测的灵敏度和特异性。将甲基化与突变两种分子特征整合,可实现从基因变异到表观调控的多维覆盖,显著提升 MRD 检测精准度并增强临床决策价值。
05 应用展望
在肿瘤精准医疗领域,DNA 甲基化标志物作为一种重要的生物标志物,在肿瘤的早期诊断、治疗方案选择及预后评估中发挥着日益关键的作用。如何高效筛选并有效验证甲基化标志物以构建肿瘤早筛模型,已成为当前研究的热点方向。为满足这一需求,纳昂达推出覆盖 10 大高发癌种的即用型甲基化检测 Panel:μCaler® FS EMS+ Panel v1.0,该 Panel 基于甲基化敏感性限制性内切酶 (MSRE) 原理并结合 μCaler® 专利型探针设计,搭载 μCaler® DNA Full Screen System 全流程解决方案可应用于肿瘤筛查和 MRD 复发监测等场景;同时,用户既可灵活调用该 Panel 中预设的候选标志物,也可定制专属探针,满足单癌种或多癌种研究需求,缩短产品开发周期,加速临床应用转化。
需要强调的是,由于临床研究和应用转化的性质,肿瘤筛查和 MRD 复发监测本质上是一个持续演进的过程,并无既定终点。未来,纳昂达将持续关注肿瘤研究领域的最新进展,依托多元化技术平台与全方位服务能力,为用户提供端到端定制化解决方案,全面支持肿瘤筛查、诊断及治疗监测全流程的技术与产品开发,携手助力肿瘤防控与管理,为肿瘤精准医疗的发展贡献力量。
参考文献
[1] Palanca-Ballester C, Rodriguez-Casanova A, Torres S, et al. Cancer epigenetic biomarkers in liquid biopsy for high incidence malignancies[J]. Cancers, 2021, 13(12): 3016.
[2] Ibrahim J, Peeters M, Van Camp G, et al. Methylation biomarkers for early cancer detection and diagnosis: Current and future perspectives[J]. European Journal of Cancer, 2023, 178: 91-113.
[3] Jin S, Zhu D, Shao F, et al. Efficient detection and post-surgical monitoring of colon cancer with a multi-marker DNA methylation liquid biopsy[J]. Proceedings of the National Academy of Sciences, 2021, 118(5): e2017421118.
[4] Li F, Zheng Z, Chen W, et al. Regulation of cisplatin resistance in bladder cancer by epigenetic mechanisms[J]. Drug Resistance Updates, 2023, 68: 100938.
[5] Ohnmacht A J, Rajamani A, Avar G, et al. The pharmacoepigenomic landscape of cancer cell lines reveals the epigenetic component of drug sensitivity[J]. Communications Biology, 2023, 6(1): 825.
[6] Parikh A R, Van Seventer E E, Siravegna G, et al. Minimal residual disease detection using a plasma-only circulating tumor DNA assay in patients with colorectal cancer[J]. Clinical Cancer Research, 2021, 27(20): 5586-5594.







