ctDNA 监测为肺癌患者点燃希望之光
01 背景
人 HER2 基因突变是非小细胞肺癌 (NSCLC) 的关键驱动突变,约占患者的 2%-3%。这些患者通常预后较差,中位生存期 (OS) 仅为 1.6-1.9 年,远低于非 HER2 突变的患者。HER2 靶向治疗药物,如阿法替尼、达可替尼和来那替尼,相比于化疗提升有限。免疫治疗在 HER2 突变患者中的疗效还有待证实。目前,化疗仍是一线治疗推荐方案,增加 HER2 靶向治疗的有效性则是提升生存期的关键。
吡咯替尼 (Pyrotinib) 是一种靶向 EGFR、HER2 和 HER4 的酪氨酸激酶抑制剂,在铂类化疗失败的 HER2 突变 NSCLC 患者中显示出显著抗肿瘤活性。阿帕替尼 (Apatinib) 作为 VEGFR2 抑制剂,与吡咯替尼联合使用显示出协同抗肿瘤效果。PATHER2 研究表明,吡咯替尼联合阿帕替尼在 HER2 突变/扩增晚期 NSCLC 患者中具有显著疗效。以非入侵的方式动态监测血液中的 ctDNA,可持续评估基因组特征、预测治疗反应和预后,为探索耐药机制和优化治疗策略提供依据。
近期,国家癌症中心联合其他单位在 Lung Cancer 上发表题为“Dynamic characterization of circulating tumor DNA in HER2-altered advanced non-small cell lung cancer treated with pyrotinib and apatinib: Exploratory biomarker analysis from PATHER2 study”的研究论文[1],该研究探讨了 33 名在接受吡咯替尼和阿帕替尼治疗的 HER2 突变晚期 NSCLC 患者中,ctDNA 监测的基因组特征及其预后相关性,并发现耐药机制与染色质重塑有关。本研究中的文库构建和杂交捕获实验基于纳昂达高性能靶向测序技术方案完成,为后续检测分析提供了关键技术支撑。
02 研究方法
2.1 样本来源
PATHER2 研究纳入的 33 名携带 HER2 突变/扩增的晚期 NSCLC 患者。其中 27 名患者血液样本用于分析。
2.2 DNA 提取、文库制备与测序
对同一患者分别提取 ctDNA 和胚系 gDNA,使用 NadPrep DNA Library Preparation Kit 构建预文库,搭配 NadPrep Hybrid Capture Reagents 进行 556 个肿瘤相关基因的目标区域富集。捕获后的文库在 Illumina Novaseq 6000 平台上进行双端测序。
2.3 数据分析
使用 Fastp (version 0.20.0) 和 BWA (Version: 0.7.12-r1039) 进行数据过滤与比对,通过 vardict-java (version 1.7.0–0) 和 GATK4 中的 Mutect2 (version4.1.8.1) 检测 SNVs 和 Indels,factera (version 1.4.4) 检测结构变异。过滤后,这些变异通过 VEP (version 104) 进行注释。所有统计分析均使用 R (version 4.0) 和 Python (version 3.8) 完成。
03 研究结果
3.1 突变一致性分析
本研究纳入了来自 PATHER2 研究的 27 名携带 HER2 突变/扩增的晚期 NSCLC 患者,这些患者至少一线化疗或 HER2 靶向治疗失败。试验中,患者每日口服 400 mg 吡咯替尼和 250 mg 阿帕替尼,直至疾病进展、不可逆毒性或死亡。在基线 (n = 27)、一个治疗周期后 (n = 13) 和疾病进展时 (n = 18) 收集外周血样本进行 ctDNA 靶向测序 (图 1.A)。中位随访时间为 41.1 个月,中位无进展生存期 (progression-free survival,PFS) 为 6.93 个月 (图 1.B),中位 OS 为 15.1 个月 (图 1.C)。初始评估时 13 名患者达到部分缓解 (PR),12 名患者疾病稳定 (SD),2 名患者疾病进展 (PD) (图 1.D)。
在吡咯替尼和阿帕替尼治疗前,21 名患者检测到 HER2 突变 (图 1.E)。从组织提取的样本进行 NGS 检测到 HER2 突变的 25 名患者中,21 名患者在 ctDNA 中也检测到 HER2 突变,其中 19 名患者突变一致,2 名患者突变不一致 (图 1.F)。这表明 ctDNA 与组织 NGS 结果中度一致。
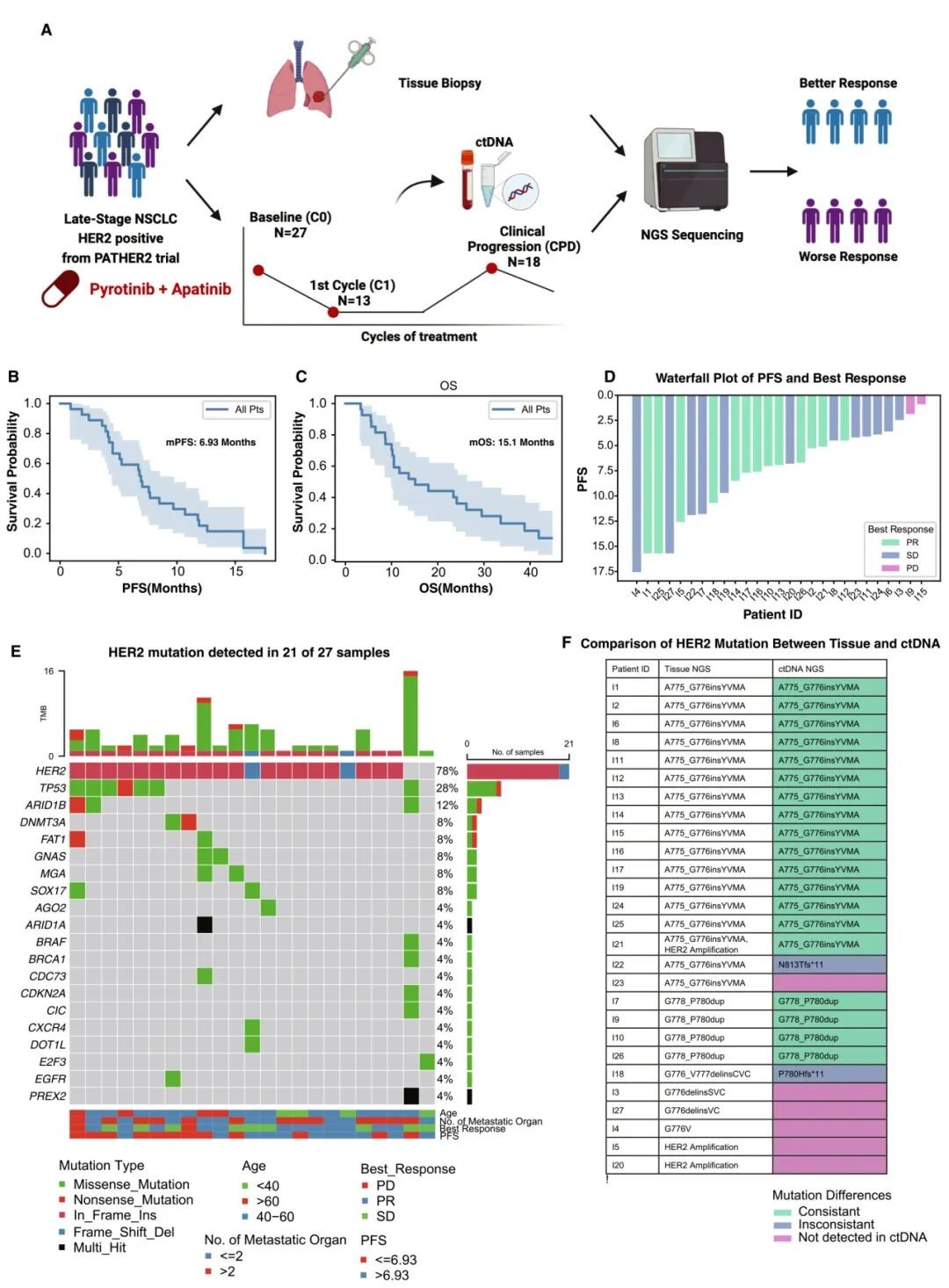
图 1. 研究设计和患者特征。
A. 患者纳入标准及 ctDNA 检测样本数量;B & C. 患者的 PFS (B) 和 OS (C) 的 Kaplan-Meier 评估;D. 患者的最佳总体疗效;E. 患者 ctDNA 的突变图谱;F. 患者配对 ctDNA 与肿瘤组织 NGS 的 HER2 突变一致性分析。
3.2 ctDNA 与预后的临床病理特征的相关性
将 27 名晚期 NSCLC 患者按中位 PFS (6.93 个月) 分为长 PFS 组和短 PFS 组,分别代表预后较好和较差的患者,比较两组的突变特征 (图 2.A 为短 PFS 组,图 2.B 为长 PFS 组)。短 PFS 组突变基因更多,TP53 VAF 更高 (图 2.C),且 TP53、DNMT3A 和 FAT1 突变与 PFS 显著相关 (图 2.D-F),而 HER2 突变频率高和突变阳性与 PFS 无显著相关性 (图 2.G)。Cox 回归分析显示,患者的年龄、性别、既往治疗线数和吸烟史与 PFS 无显著相关性。此外,TP53 和 DNMT3A 突变与 PFS 独立相关 (图 2.H),表明 ctDNA 突变信息在预测吡咯替尼和阿帕替尼疗效中具有重要价值。
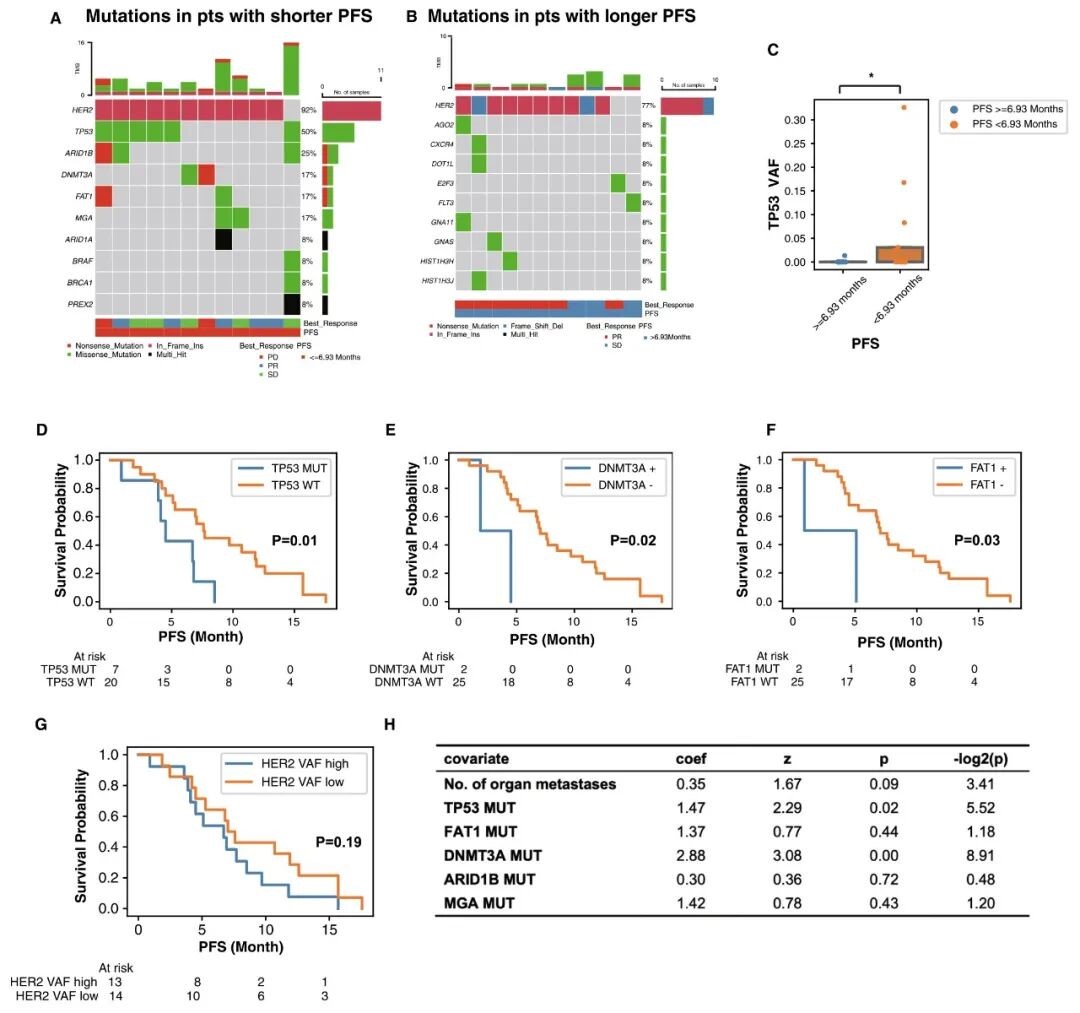
图 2. 与患者预后相关的 ctDNA 特征。
A & B. 按 PFS 长度分组的 ctDNA 突变图谱 (A. PFS 短于 6.93 个月的患者;B. PFS 长于 6.93 个月的患者);C. 长 PFS 组和短 PFS 组之间 TP53 突变 VAF 的差异;D-F. 按 TP53 (D)、DNMT3A (E)、FAT1 (F) 共突变状态分组的患者 PFS 的 Kaplan-Meier 估计;G. 按 HER2 VAF 丰度分组的患者 PFS 的 Kaplan-Meier 估计;H. Cox 多变量回归分析评估临床和 ctDNA 基因组特征与患者 PFS 的相关性。单变量 Cox 分析中 P < 0.1 的变量被纳入模型。
3.3 ctDNA 水平的动态变化与疗效的相关性
为了探索 ctDNA 动态变化与治疗疗效的相关性,该研究分析了第一个治疗周期 (C1) 后的 ctDNA 特征。发现短 PFS 组的平均 HER2 VAF 显著高于长 PFS 组 (图 3.A),表明 C1 时 HER2 突变清除与更好预后相关。未检测到 HER2 突变的患者 PFS 更长 (7.5 个月 vs. 4.4 个月) (图 3.B),且 OS 有延长趋势 (23.1 个月 vs. 15.3 个月) (图 3.C)。几乎所有患者在 C1 时的 HER2 VAF 均为最低值,长 PFS 组的 HER2 VAF 下降更明显 (图 3.D & E)。比较非脱落、清除和持续存在 ctDNA 特征患者的 PFS (图 3.F),清除组和非脱落组 PFS 相似,但清除组 PR 比例更高,而 ctDNA 持续存在的患者 PFS 最短,表明基线和 C1 时 ctDNA 对评估治疗效果具有重要参考意义。
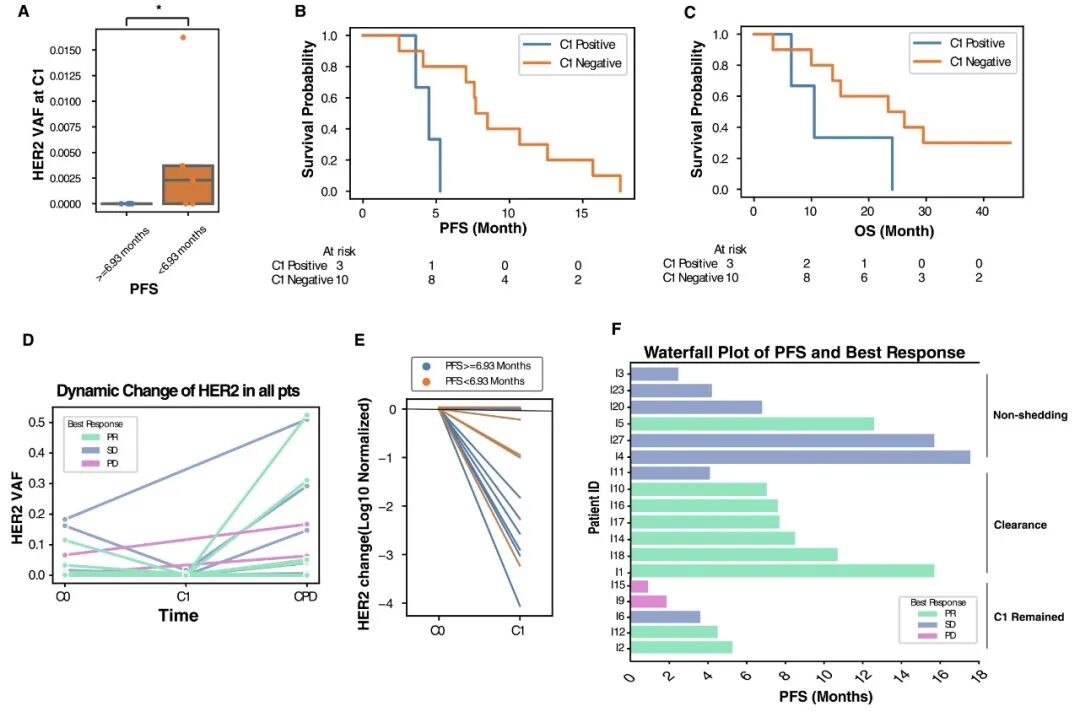
图 3. 一个治疗周期后 ctDNA 动态变化与患者预后结果的相关性。
A. 长 PFS 组和短 PFS 组 HER2 突变 VAF 的差异;B & C. 按 C1 时 HER2 突变状态分层的患者 PFS (B) 和 OS (C) 的 Kaplan-Meier 估计;D. 治疗期间 HER2 突变频率的动态变化;E. 基线与一个治疗周期后 HER2 突变频率差异的比较;F. ctDNA 非脱落、清除和持续存在患者的最佳总体疗效和 PFS。
3.4 吡咯替尼和阿帕替尼耐药的潜在机制
通过分析疾病进展患者的 ctDNA 水平,该研究探索了吡咯替尼和阿帕替尼耐药的潜在机制。疾病进展 ctDNA 的 HER2 VAF 显著增加,表明其与耐药相关 (图 4.A)。长 PFS 组和短 PFS 组之间的 HER2 变化程度无显著差异 (图 4.B)。在 18 名疾病进展后患者中,仅 3 名出现 ctDNA 未检测到的新突变 (图 4.C),其中 G776C 突变在疾病进展后样本中被发现,其可能是继发耐药机制。短 PFS 患者并未表现出更多突变,且 HER2 和 TP53 突变在少数样本中作为新突变出现 (图 4.D & E)。新突变基因主要富集于染色质重塑通路,提示表观遗传修饰可能是导致吡咯替尼和阿帕替尼耐药的重要机制 (图 4.F)。
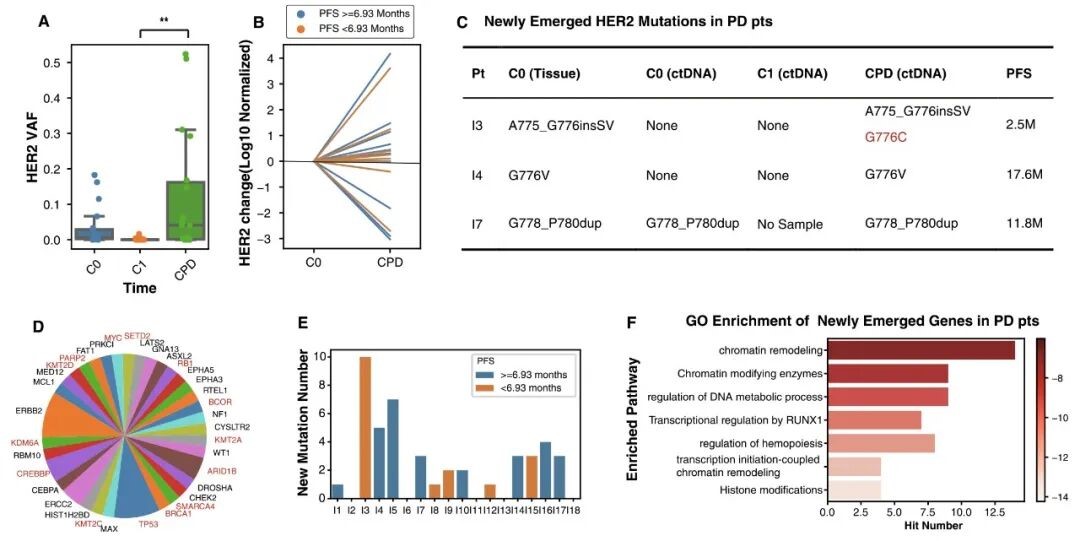
图 4. 疾病进展后患者的 ctDNA 水平。
A. 不同时间段 HER2 突变 VAF 的差异;B. 一个治疗周期后与疾病进展后 HER2 突变频率差异比较;C. 疾病进展患者中新出现的 HER2 突变;D. 疾病进展后患者新出现的共突变;E. 患者新突变的数量;F. 疾病进展后新突变的基因本体论富集分析。
04 讨论
本研究通过 ctDNA 动态监测探索了接受吡咯替尼和阿帕替尼治疗的 HER2 突变/扩增晚期 NSCLC 患者的基因组特征及其与预后的相关性。研究发现,ctDNA 检测的 HER2 突变与组织 NGS 结果一致性为 76%,TP53 和 DNMT3A 突变是预后不良的独立风险因素。C1 时未检测到 HER2 突变的患者 PFS 更长,OS 有延长趋势,而 HER2 突变持续存在的患者 PFS 最短。HER2 突变肺癌对吡咯替尼和阿帕替尼的耐药可能主要由染色质重塑通路 (尤其是 SWI/SNF 复合物) 驱动,而非 HER2 靶向突变。未来可通过联合治疗 (如 HDAC 或 DNMT 抑制剂) 克服耐药,提高疗效,这些发现可能有助于指导抗 HER2 靶向治疗的临床应用。
参考文献
Dong Y, Yang G, Yang Y, et al. Dynamic characterization of circulating tumor DNA in HER2-altered advanced non-small cell lung cancer treated with pyrotinib and apatinib: Exploratory biomarker analysis from PATHER2 study[J]. Lung Cancer, 2025, 200: 108062.







