基因治疗有风险,如何更好评估安全性?μCaler 助力更精准整合分析
慢病毒载体 (Lentiviral vectors, LVs) 是以 HIV-1 (人类免疫缺陷 I 型病毒) 为基础发展起来的基因治疗载体。该载体可以将目的基因或基因操纵工具整合到分裂和非分裂细胞的基因组中,即能够将外源基因高效地整合到宿主的染色体上,从而实现外源基因的持久性表达。

图 1. 慢病毒载体制备及感染过程示意图
慢病毒载体的整合风险
作为被广泛使用的基因治疗载体,慢病毒载体系统有宿主范围广、表达时间长及免疫原性小等特点。但是,其插入宿主基因组的位点是不确定的。这种不确定性的基因整合可能引起原癌基因的激活、抑癌基因的失活、RNA 剪接、基因融合等,从而带来致癌风险。
根据国家药品监督管理局药品审批中心 (CDE) 发布的《基因修饰细胞治疗产品非临床研究与技术指导原则 (试行)》,基因治疗药物将遗传物质转移到宿主细胞内或整合到宿主基因组中或对宿主基因组进行编辑,存在潜在的遗传毒性风险,需要分析基因组改变的特征,并评估相关潜在风险。对整合位点的检测是 CDE 放行慢病毒治疗产品的重要依据 (图 2.)[1]。

图 2. 整合型基因治疗载体安全监测
慢病毒整合位点分析主要包括两个方面:一是确定慢病毒载体整合位点,二是评估整合细胞克隆的多样性。通过对慢病毒整合位点的分析,可以了解到外源基因整合到染色体的位置,从而预测其可能的影响;通过治疗后的临床随访及分析特定整合位点的分布比例,可评估是否产生优势克隆细胞,以及是否存在引起癌变的风险。
整合位点分析方法
当前较为通行的做法是基于 LAM-PCR (Linear amplification
mediated PCR) 结合二代测序方法检测整合位点。其原理是利用线性扩增和磁珠分离来富集载体-基因组连接处,然后在半固体链霉亲和素相上进行双链合成、限制性酶切、连接子连接和指数 PCR 等步骤,最后通过测序来鉴定未知的基因组序列。这种方法能够完整检测绝大多数插入事件。但是在特定情况下,如样本投入量大、整合事件数量众多或 PCR 不易扩增的位点,对某些整合事件的检测有效性将显著降低。其主要原因在于:1) 非均一性扩增。过多的 PCR 循环数会造成各个插入事件的相对丰度关系发生显著变化;2) 不适用于大量整合事件的检测。受限于投入量和 PCR 偏好性,当大幅增加投入量时,会遗漏部分整合位点。
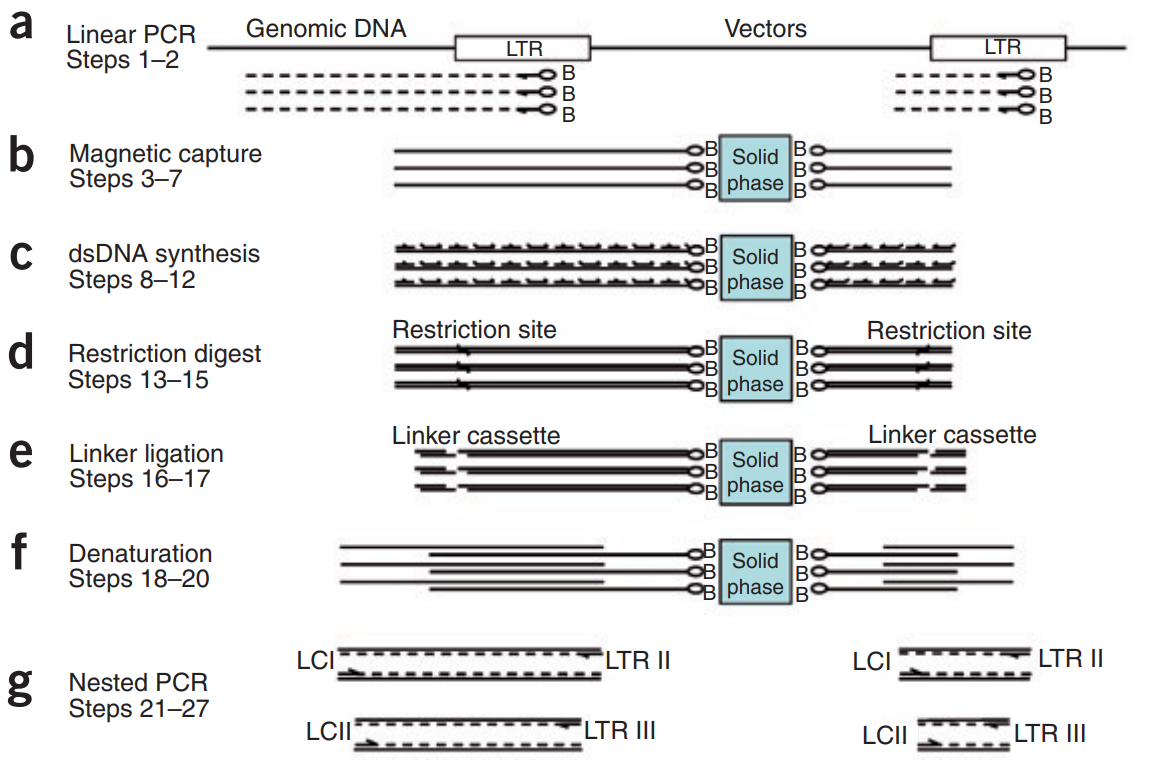
图 3. LAM-PCR 的基本过程[2]
中吉智药与纳昂达合作,共同开发了基于 μCaler 探针捕获技术的新一代 ISA 分析方法——ISAKey。
μCaler 技术是纳昂达持有国际专利的一项创新技术 ,其巧妙的结构设计优势,利用分子共轭效应,增加了靶向捕获的结合力、准确性,也提高了样品的最低检出限,同时大大降低了测序成本。新一代 ISA 分析方法 ISAKey 在富集目的基因时采用了这种创新的多探针靶向捕获技术,实验流程简化升级,可在单日内完成全部实验 (图 4.)。

图 4. ISAKey 原理图
ISAKey 方法学验证
我们使用 5 例已知插入位点的单克隆样本,从专属性、准确性、精密度、线性、定量限、检测限、耐用性等方面对 ISAKey 进行了系统的方法学验证 (表 1.)。结果表明,该方法在 0.75%-50% 范围内均能精确定量整合频率和位置。然后,我们使用 WHO 标准品测试,其结果重复性好且与国际实验室检测结果高度一致 (表 2.)。
表 1. ISAKey 方法验证结果

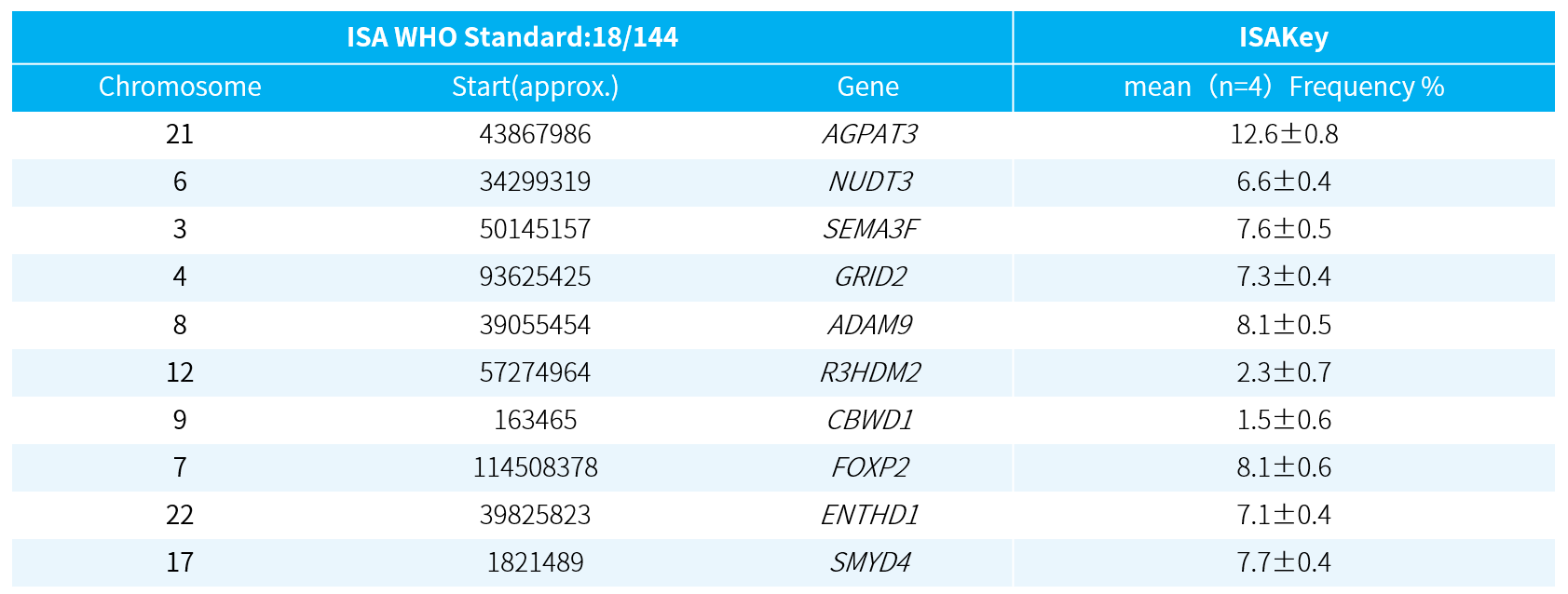
表 2. ISAKey 检测 WHO 标准品
方法学对比
我们使用 ISAKey 和 LAM-PCR 法同时检测一例慢病毒载体转导的用于治疗地中海贫血的造血干细胞基因组,进行直接对比。尽管 ISAKey 在 DNA 投入量上只有 LAM-PCR 法的 1/10,但实际检出 18,045 个 Split Read,远远高于 LAM-PCR 法的 10,354 个,且在基因组上均匀分布 (图 5.)。分析时选取了相同数据量,这意味着 ISAKey 的灵敏度更高。
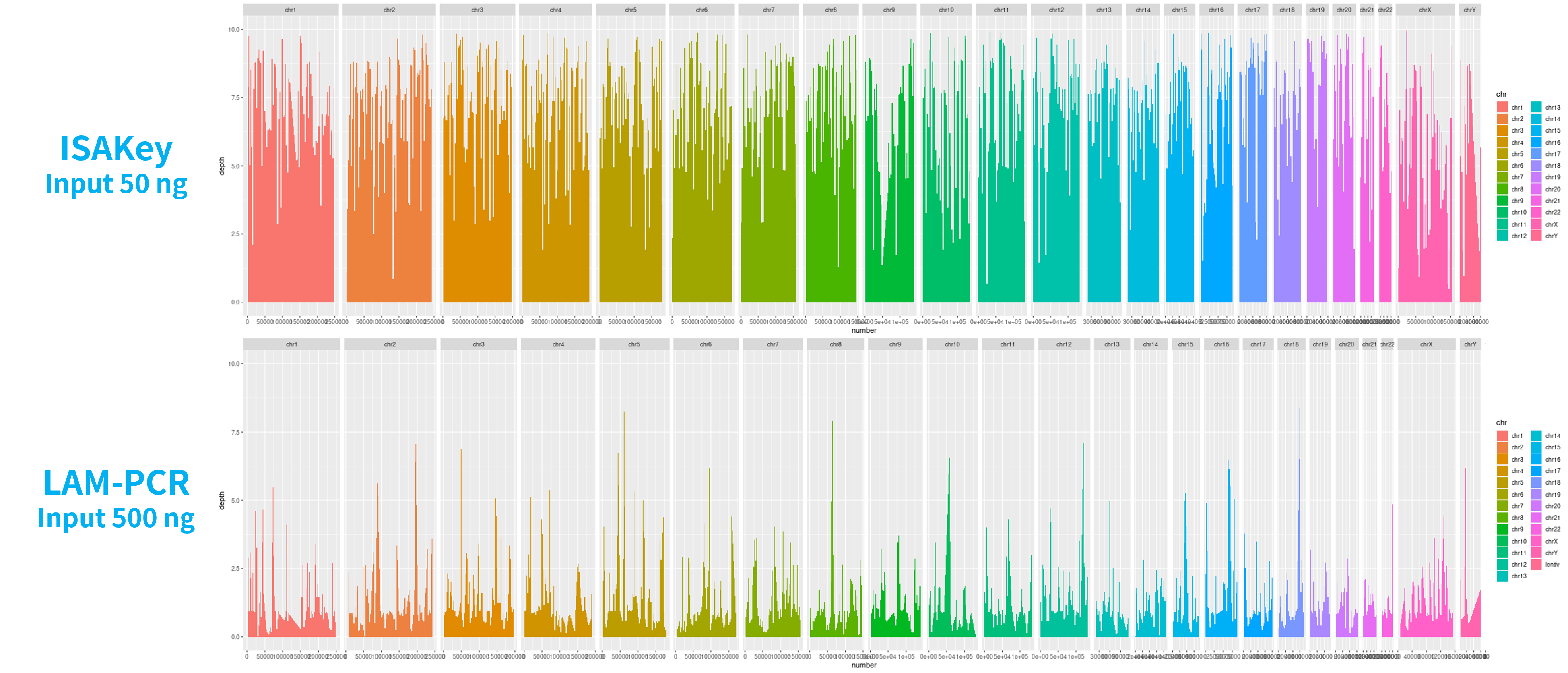
图 5. 两种方法检测染色体 Split Read 分布和深度的对比
注 1:Split Read 指 Read 的一部分在人类基因组上,而另一部分在慢病毒的基因组上,可代表整合位点的数量。不同色柱代表不同的染色体。
注 2:在临床样本中,ISAKey 检测出插入位点数为 18,045,LAM-PCR 检测出插入位点数为 10,354。
检测结果分析
临床随访样本中,ISAKey 法共检测到 18,045 个整合位点,但排名前 10 的整合位点 reads 数仅为 720 个,占比 0.66% (图 6.)。这些整合位点在基因组上呈现均匀分布,无显著插入偏好 (图 7.)。这表明在克隆细胞呈现多样性且整合位点的无明显偏好性。

图 6. 慢病毒载体转染细胞后整合位点 Top10
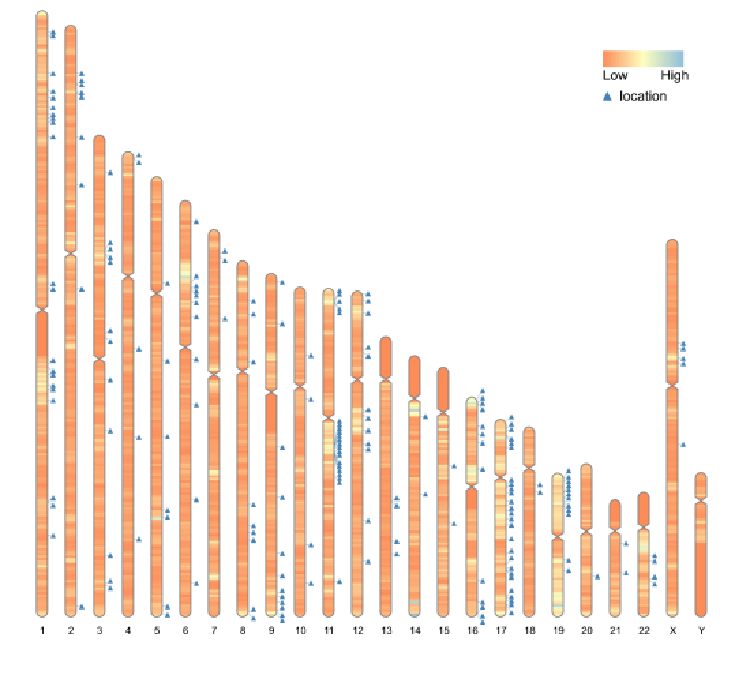
图 7. 整合位点在染色体分布偏好性
对整合位点和 >1,000 个癌症相关基因的分析显示,位于每个基因的转录起始位点 ±100 Kb 处的整合位点克隆数占比均极低,最高值为 0.2%,无优势克隆形成。这表明癌症相关基因可能受到整合位点的影响较小。
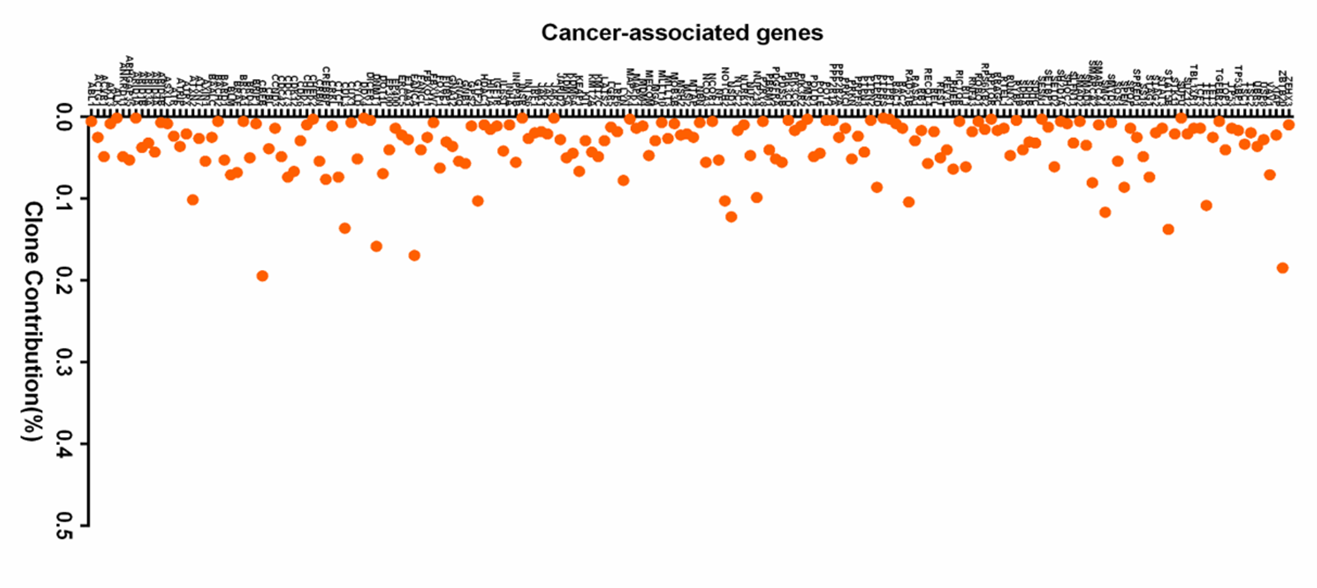
图 8. 整合位点在肿瘤相关基因的分布统计
ISAKey 从最初方法设计到现在验证成熟,历经了两年时间进行优化完善,已跑通从检测到全面分析的完整路径,对于低质量、微量的样本,也可快速准确地完成检测分析。随着生物技术的不断进步,未来基因治疗可应用的疾病也将越来越多。在快速发展的同时,基因治疗的安全性始终是最重要的考量因素之一。不断提高检测的能力和水平,实现精准检测,是未来的发展趋势。
参考文献
[1] 国家药监局药审中心. 基因修饰细胞治疗产品非临床研究技术指导原则 (试行). 2021.11.30.
https://www.cde.org.cn/main/news/viewInfoCommon.
[2] Schmidt M, Schwarzwaelder K, Bartholomae C, et al. High-resolution insertion-site analysis by linear amplification–mediated PCR (LAM-PCR)[J]. Nature methods, 2007, 4(12): 1051-1057.







