NEXome 全外显子组 Panel 助力揭示 PD-1 抑制剂新辅助治疗食管鳞状细胞癌疗效
01背景
免疫检查点阻断 (Immune checkpoint blockade, ICB) 为改善食管鳞状细胞癌 (Esophageal Squamous Cell Carcinoma, ESCC) 患者的生存提供了新的策略,其原理是通过阻断表达免疫检查点的肿瘤细胞与免疫细胞之间的相互作用,从而来解除肿瘤细胞对免疫细胞的抑制作用。有研究表明,抗 PD-1 单克隆抗体与铂类化疗的组合疗法相较于单独化疗表现出更优越的疗效。多项研究尝试评估化疗联合免疫治疗在可切除 ESCC 患者中的可行性和有效性。
然而,PD-L1 表达无法解释 ESCC 患者对免疫治疗效果的差异性,肿瘤突变负荷 (Tumor Mutational Burden,
TMB) 的预测效果也存在较大争议。ESCC 新辅助化学免疫治疗效果的细胞和分子机制仍不清楚,这阻碍了免疫检查点阻断治疗受益人群的进一步扩大。
2024 年 1 月 19 日,复旦大学附属中山医院和复旦大学生物医学研究院葛棣、古杰和刘荣花团队在 eBioMedicine (IF=11.1) 期刊上发表了题为 “Genomic profiling and
associated B cell lineages delineate the efficacy of neoadjuvant
anti-PD-1-based therapy in oesophageal squamous cell carcinoma” 的研究论文。研究团队通过整合 24 例接受 PD-1 抑制剂联合紫杉醇和铂类化疗新辅助治疗的 ESCC 患者样本的全外显子组测序 (Whole-exome sequencing,
WES)、单细胞 RNA 测序和免疫荧光数据,以揭示影响 ESCC 新辅助治疗效果的决定性因素。其中 WES 测序方案的文库构建和靶向捕获试剂,包括全外显子捕获 Panel (NEXome Plus Panel v1.0),全部来自纳昂达 (Nanodigmbio)。

02研究方法
2.1患者人群
该研究纳入了经组织学证实的 24 例局部晚期食管鳞状细胞癌患者,时间跨度为 2021 年2 月至 2022 年 1 月。所有患者在接受 R0 根治性手术前,均接受了术前抗 PD-1 治疗加紫杉醇-铂类化疗 2-4 个周期。研究人员采用 Mandard 肿瘤退缩分级 (Tumour Regression Grade, TRG) 系统以评估治疗效果,该系统与食管癌新辅助治疗后的死亡率相关。根据该系统,TRG 分级为 1-2 的患者被视为应答者,而 TRG 分级为 3-5 的被视为非应答者。
2.2全外显子组测序 (WES) 和体细胞变异检测
从 FFPE 组织样本中提取 DNA,利用 NadPrep DNA Library Preparation Module (for MGI) 进行预文库构建,投入量为 500 ng FFPE DNA;以 NadPrep Hybrid Capture
Reagents 和 NEXome Plus Panel v1.0 完成靶向捕获。WES 文库于 DNBSEQ-T7RS 测序仪进行 150 bp双端测序,测序深度为 300-500x。该研究发现,术前样本中 C>T 转换的频率与癌症基因组图谱 (TCGA)-ESCC 队列中报道的频率相一致。在生物信息学过滤过程中,变异等位基因频率阈值设定为 5%。
使用 GVC (Genomic Variant Caller) 算法检测体细胞变异,该算法采用机器学习模型计算肿瘤和正常对照样本不同基因型的单核苷酸变异 (SNVs)、小片段插入和缺失 (Indels) 以及拷贝数变异 (CNVs) 的概率。GVC 从与融合候选基因相关的 BAM 文件中提取 reads,并提取融合断点附近的特征信息以分析结构变异信息。
2.3突变分析和人类白细胞抗原 (Human
leucocyte antigen, HLA) 分型
突变特征分析使用 deconstructSigs (1.6.0) 参考 COSMIC 数据库进行。每个肿瘤及其配对正常样本使用 Polysolver
(4.0) 按照 WES 默认参数进行 HLA I分型。HLA 杂合性缺失 (Loss of Heterozygosity, LOH) 被定义为HLA I类位点 (HLA-A/B/C) 上的杂合性缺失。使用 LOHHLA 工具进行 HLA I类位点杂合性缺失的分析。拷贝数小于 0.5 的 HLA 等位基因在统计上被认为发生杂合性缺失。
03研究结果
3.1ESCC 的外显子突变特征与治疗反应有关
为了剖析食管鳞状细胞癌 (ESCC) 患者的基因组特征并确定治疗效果的决定性因素,研究人员对 24 名接受新辅助 PD-1 抑制剂联合紫杉醇铂类化疗和随后手术的 ESCC 患者的 FFPE 样本进行了全外显子测序 (WES)、单细胞 RNA 测序 (scRNA-seq) 和免疫组织化学/多重免疫荧光 (mIF) 分析。治疗效果通过计算机断层扫描进行评估,并经过病理复查 (图 1. b)。根据 TRG 系统,4 名患者达到 TRG 1级,8 名患者达到 TRG
2级,12 名患者为 TRG 3-5级 (图 1. c)。通过对 23 份治疗前组织的 WES 分析发现,应答者的肿瘤突变负荷 (TMB) 高于无应答者 (5.52/Mb vs 2.76/Mb; P = 0.038) (图 1. d)。
然而,治疗前的 TMB 并不是预测治疗反应的显著因素。研究人员发现,与无应答者的样本相比,应答者样本携带的 Indel 明显更高,而不是 SNV。基于治疗前 SNV、Indel 和 CNV 的预测值表明,Indel 显示出最高的 AUC (area under the curve) 值。总之,这些结果表明,治疗前 Indel 可预测ESCC 患者对新辅助化学免疫疗法的反应,与其他潜在因素无关。
有趣的是,研究人员观察到 FAT1 突变在治疗后无应答者中完全保留 (图 1. e)。POLE、MLH1 和 OGG1 突变仅在治疗前的应答者中发现,这表明 DNA 损伤修复 (DNA damage repair, DDR) 缺陷可能与 ESCC 的治疗反应有关。此外,对治疗前样本中应答者和无应答者之间的通路变异频率进行比较显示,应答者 PI3K、BER、DNA 错配修复(DNA mismatch repair, MMR) 和 FA 通路的变异频率增加 (图 1. f)。在这项分析中,如果在术前组织中发现通路中的基因突变,则认为患者携带通路突变。在突变特征分析中,TRG 1 级患者的显著特征是 MMR 途径的缺乏 (图 1. g)。
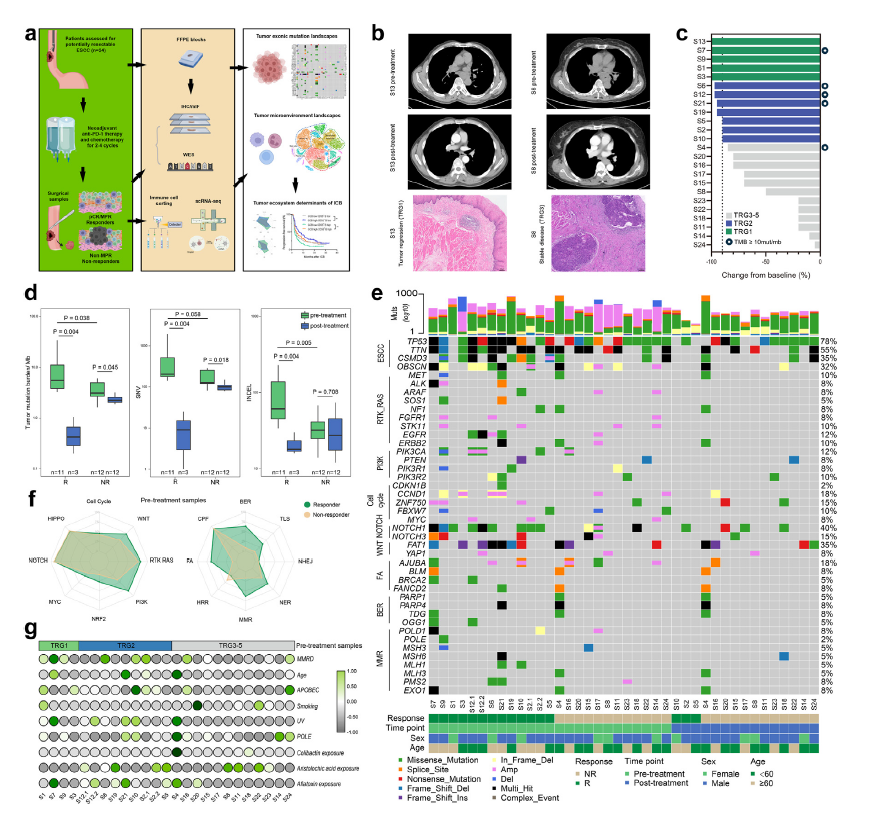
图 1. ESCC 与治疗反应相关的外显子突变特征。 (a) 研究工作流程图,总结了本研究中基因组和免疫谱分析的过程;(b) 患者治疗期间获取的典型计算机断层扫描图像和 H&E 染色图像,比例尺 100 μm;(c) 每个纳入分析患者的病理反应条形图;(d) 比较应答者和无应答者之间治疗前后的 TMB、SNV 和 Indel 的箱线图;(e) 根据病理反应匹配的 ESCC 患者治疗前和治疗后样本的基因组变化图谱;(f) 雷达图显示了治疗前样本中应答者 (n = 11) 和无应答者 (n = 12) 中通路变化的频率;(g) 热图展示了根据病理反应匹配的 ESCC 患者治疗前样本中的突变特征。
为进一步探究 DDR 途径与治疗效果间的关系,研究人员将 MMR、BER 或 FA 途径发生变化的肿瘤定义为具有 DDR 变化的肿瘤。单变量逻辑分析显示,综合治疗前 DDR 方案在预测疗效方面具有很强的潜力 (图 2. a)。在治疗前样本中,具有 DDR 变化的肿瘤具有更高的 TMB 和 SNV 水平,当比较两组之间的 Indel 数量时,这种差异更显著 (图 2. b)。
有趣的是,研究人员注意到,一些治疗前具有较高 TMB 水平或 DDR 变化的患者仍然表现出临床益处。由于抗原呈递的缺陷可能会阻碍新抗原的识别和免疫反应的激活,研究人员接下来检查了 HLA的 LOH 和抗原呈递机制相关基因的变化。尽管抗原呈递机制缺陷在应答者和无应答者之间没有差异 (图 2. c),但在治疗前后仅在无应答者中观察到 HLA 的 LOH (图 2. c 和 d )。研究人员进一步发现,所有治疗前 DDR 变化和 HLA 完整的患者对化疗免疫疗法有反应 (图 2. d)。因此可以推断,只有当 HLA 保持完整时,治疗前 DDR 的变化才可能促进免疫反应。
在不同 DDR 状态的患者中,与其他 DDR 变化或无 DDR 变化的患者相比,MMR 变化患者的免疫细胞显著升高 (图 2. e),这意味着适应性免疫反应增加。同时在治疗前样本中,MMR 突变基因的数量与治疗后残留存活肿瘤细胞的百分比呈负相关 (图 2. f)。另外研究人员应用新抗原结合亲和力来确定 MMR 改变是否与高亲和力突变相关新抗原 (Mutation-associated neoantigens, MANA) 相关。在伴有 MMR 变化的 ESCC 样本中,治疗前携带 Indel 介导新抗原肿瘤的比例高于不伴有 MMR 变化的肿瘤 (图 2. g)。桑基图展示了动态基因组图谱和治疗反应之间的关系 (图 2. h)。总之,研究结果表明,DDR 的改变,特别是 MMR 的改变,可能会增加激活免疫反应的 MANA 负担,从而影响新辅助化学免疫疗法的临床结果。
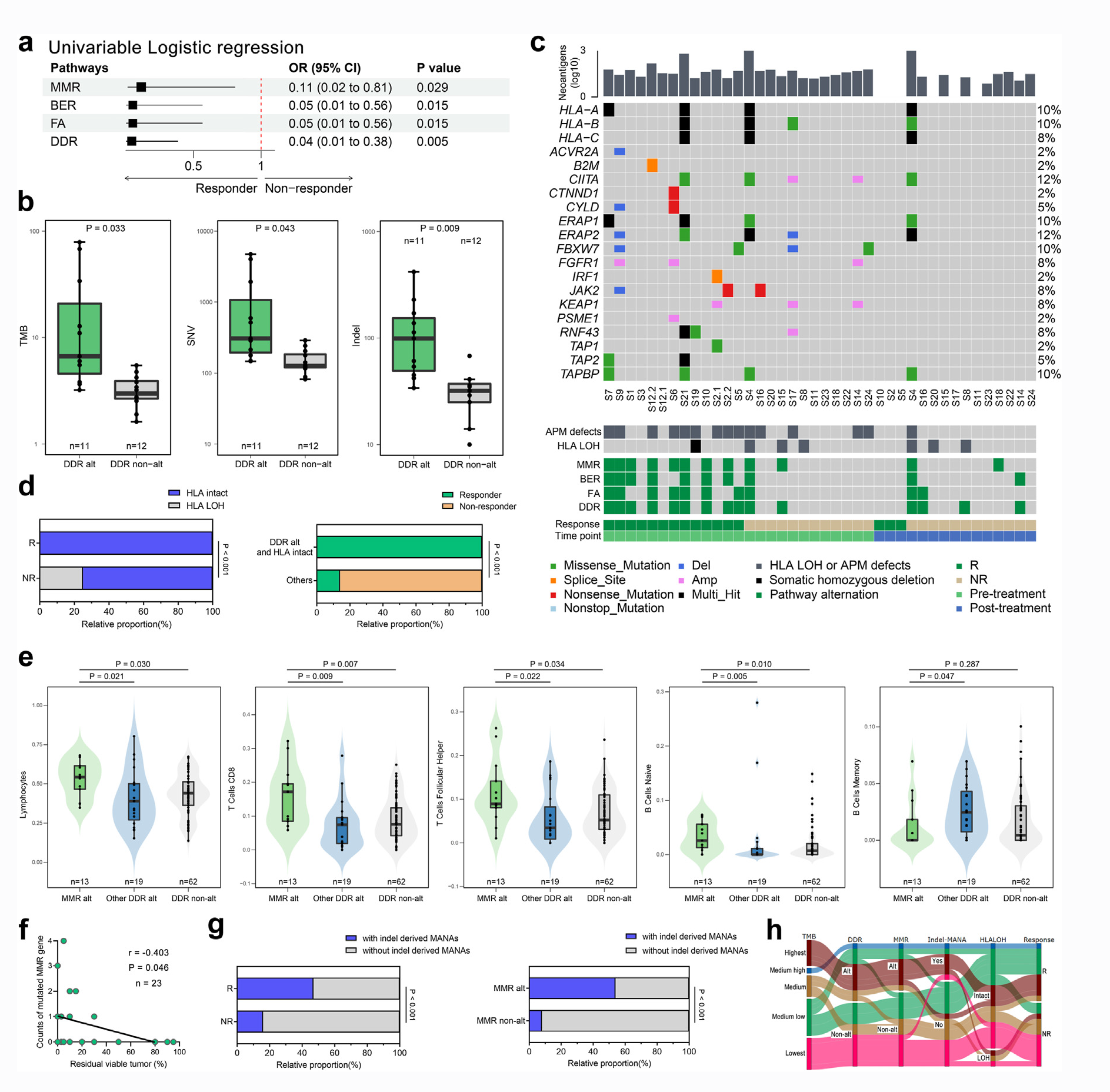
图 2. 受损的 DNA 修复途径与治疗反应的关系。(a) 森林图表示与单变量逻辑回归模型确定的 95% 置信区间边界相对应的带误差线的比值比 (Odd ratios,OR);(b) 箱线图比较了具有和不具有 DDR 变化的患者之间术前 TMB、SNV 和 Indels;(c) ESCC 患者术前和术后样本中,根据病理反应匹配的抗原呈递基因变化和 HLA LOH 状态的情况;(d) 左:应答者 (n=11) 与无应答者 (n=12) 术前 HLA LOH 事件的比例分别为 0% vs 36.6%;右:术前 DDR 变异和 HLA 完整的患者 (n=9) 与其它患者 (n=14) 中应答者的比例分别为 100% vs 15.4%;(e) 淋巴细胞、CD8+ T细胞、滤泡辅助性 T 细胞、原始 B 细胞和记忆 B 细胞在不同 DDR 状态患者中分布情况的小提琴图;(f) 治疗中突变的 MMR 基因数量与残存活肿瘤的相关性 (%);(g) 治疗前具有插入缺失 MANA 的患者在应答者和无应答者中占比分别为 47% vs 16% (左),在 MMR 变异组与 MMR 未变异组占比分别为 54% vs
8% (右);(h) 桑基图描述了动态基因组图谱和治疗反应之间的关系。
04总结
新辅助化学免疫疗法的发展在治疗局部晚期 ESCC 上显示出可控的安全性和良好的疗效。目前尚无分子或免疫标志物用于指导 ESCC 患者的精准治疗策略。该研究通过对 ESCC 患者 FFPE 样本的 WES 测序,揭示了 DNA 错配修复 (MMR) 途径改变与治疗效果之间存在显著相关性。此外结合转录组 B 细胞谱系特征等信息的全面评估可以有效预测免疫疗法的效果,以期改善 ESCC 患者接受新辅助化学免疫治疗的选择和管理。







